题目内容
9.某元素R的最高价氧化物的化学式为RO2,其气态氢化物中氢的质量分数为25%,此元素是( )| A. | C | B. | N | C. | Si | D. | S |
分析 元素R的最高价氧化物化学式为RO2,则X元素最高价为+4价,故气态氢化物RH4,根据氢化物中H元素的质量分数求出R的相对原子质量,据此确定R为何元素.
解答 解:元素R的最高价氧化物化学式为RO2,则X元素最高价为+4价,故气态氢化物RH4,R的气态氢化物中氢的质量分数为25%,则RH4的相对分子质量为:$\frac{4}{25%}$=16,则R的相对原子质量为:16-4=12,则R为C元素,
故选:A.
点评 本题考查元素推断、化学式中元素质量分数的有关计算等,注意对基础知识的理解掌握,题目难度不大.

练习册系列答案
相关题目
18.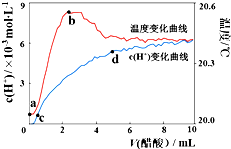 室温下,将10.00mL 5.0000mol•L-1醋酸滴入100.00mL蒸馏水中,溶液中c(H+)和温度随着醋酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将10.00mL 5.0000mol•L-1醋酸滴入100.00mL蒸馏水中,溶液中c(H+)和温度随着醋酸体积变化曲线如图所示.下列有关说法正确的是( )
 室温下,将10.00mL 5.0000mol•L-1醋酸滴入100.00mL蒸馏水中,溶液中c(H+)和温度随着醋酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将10.00mL 5.0000mol•L-1醋酸滴入100.00mL蒸馏水中,溶液中c(H+)和温度随着醋酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | a~b段,醋酸电离过程为放热过程 | |
| B. | c~d段,c(H+)增加,醋酸电离度增加 | |
| C. | c点时,加入等体积等浓度的NaOH溶液则:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| D. | d点时,c(H+)>c(CH3COOH) |
19.对于化学反应A(g)+3B(g)?3C(g),下列措施既可加快反应速度,有可提高A的转化率的是( )
| A. | 使用催化剂 | B. | 增大A物质的浓度 | C. | 增大B物质的浓度 | D. | 减少C物质的浓度 |
17.向AgCl浊液中滴加氨水后可得澄清溶液,继续滴加浓硝酸又有沉淀生成,经查资料得知:Ag++2NH3•H2O?[Ag(NH3)2]++2H2O,下列分析不正确的是( )
| A. | 实验表面实验室可用氨水洗涤银镜反应后的试管 | |
| B. | 实验可以证明NH3结合Ag+能力比Cl-强 | |
| C. | 浊液中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq) | |
| D. | 由资料信息科推知:加浓硝酸后生成的沉淀为AgCl |
14.LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车.电池反为:FePO4+Li═LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质.下列有关LiFePO4电池说法正确的是( )
| A. | 可加入硫酸以提高电解质的导电性 | |
| B. | 放电时电池内部Li+向负极移动 | |
| C. | 充电过程中,电池正极材料的质量增加 | |
| D. | 放电时电池正极反应为:FePO4+Li++e-═LiFePO4 |
1.化学与生产和生活密切相关,下列说法正确的是( )
| A. | 甘油可用于配制化妆品 | |
| B. | 福尔马林可用于食品、标本、木材等的防腐 | |
| C. | 食品饮料中的菠萝酯,只能从菠萝中提取,不能通过有机合成生产 | |
| D. | 在野外,被黑蚂蚁蜇伤后,涂抹烧碱液可以缓解因注入皮肤内的蚁酸带的疼痛 |
18.甲酸的下列性质中,可以证明它是弱电解质的是( )
| A. | 1 mol•L-1甲酸溶液的pH约为2 | |
| B. | 甲酸能与水以任意比例互溶 | |
| C. | 10 mL 1 mol•L-1甲酸恰好与10 mL 1 mol•L-1 NaOH溶液完全反应 | |
| D. | 甲酸溶液的导电性比强酸溶液弱 |
19.金属钛对体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称.下列有关${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti的说法中正确的是( )
| A. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti原子中均含有22个中子 | |
| B. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti质子数相同 | |
| C. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti质量数不同,不能互称同位素 | |
| D. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti化学性质不同 |