题目内容
下列现象或事实可用同一原理解释的是
| A.铁在冷的浓硫酸中和铝在冷的浓硝酸中都没有明显变化 |
| B.浓硫酸和浓盐酸长期暴露在空气中浓度降低 |
| C.SO2、漂白粉、活性炭、过氧化钠都能使红墨水褪色 |
| D.漂白粉和水玻璃长期暴露在空气中变质 |
A
解析试题分析:A.铁在冷的浓硫酸中和铝在冷的浓硝酸中都没有明显变化,都是金属铁和铝的钝化现象;B.浓硫酸和浓盐酸长期暴露在空气中浓度降低,前者是吸水,后者是挥发,原理不同;C.使红墨水褪色SO2是化合反应,漂白粉、过氧化钠是氧化,活性炭是吸附;D.长期暴露在空气中:漂白粉是吸潮后与CO2生成HClO,然后分解而变质;水玻璃是直接与CO2反应生成Na2CO3和硅酸而变质。
考点:化学现象的原理解释。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列物质的转化在给定条件下不能实现的是
A.Ca(ClO)2(aq)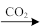 HClO(aq) HClO(aq) HCl(aq) HCl(aq) |
B.H2SiO3 SiO2 SiO2 SiCl4 SiCl4 |
C.Al2O3 NaAlO2(aq) NaAlO2(aq)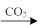 Al(OH)3 Al(OH)3 |
D.Fe2O3 Fe2(SO4)3(aq) Fe2(SO4)3(aq) 无水Fe2(SO4)3 无水Fe2(SO4)3 |
a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。已知:①a、c皆能与稀硫酸反应放出气体;②b与d的硝酸盐反应,置换出单质d;③c与强碱反应放出气体;④c、e在冷浓硫酸中发生钝化。由此可判断a、b、c、d、e依次为
| A.Fe Cu Al Ag Mg | B.Al Cu Mg Ag Fe |
| C.Mg Cu Al Ag Fe | D.Mg Ag Al Cu Fe |
下列有关物质的性质和该性质的应用均正确的是
| A.SiO2具有较好的导电性,可用于制造半导体材料 |
| B.H2O2是一种绿色氧化剂,可氧化酸性高锰酸钾而产生O2 |
| C.铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
| D.Mg在空气中燃烧发出耀眼的白光,可用于制作信号弹 |
将5.4 g Al 投入到200mL 2.0 mol/L的某溶液中有氢气产生,充分反应后有金属剩余。该溶液可能为
| A.HNO3溶液 | B.Ba(OH)2溶液 | C.H2SO4溶液 | D.HCl溶液 |
对于实验Ⅰ~Ⅳ的实验现象预测正确的是
| A.实验Ⅰ:逐滴滴加盐酸时,试管中立即产生大量气泡 |
| B.实验Ⅱ:充分振荡后静置,下层溶液为橙红色,上层无色 |
| C.实验Ⅲ:从饱和食盐水中提取NaCl晶体 |
| D.装置Ⅳ:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅直至褪去 |
用黄色的FeCl3溶液分别进行下列实验,解释或结论不正确的是 ( )。
| 选项 | 实验 | 现象 | 解释或结论 |
| A | 加入FeCl3固体 | 溶液变成红褐色 | FeCl3的水解程度变大 |
| B | 加入等体积水 | 溶液颜色变浅 | c(Fe3+)变小 |
| C | 加入足量Fe粉 | 溶液颜色变成浅绿色 | 2Fe3++Fe=3Fe2+ |
| D | 将FeCl3溶液微热 | 溶液变成红褐色 | 水解反应ΔH>0 |
