题目内容
A、B、C、D、E分别是 Cu、Ag、Fe、Al、Mg五种金属中的一种。已知:(1)A、C均能与稀 H2SO4反应放出气体;(2)B与D的硝酸盐反应,置换出单质D;(3)C与强碱反应放出气体;(4)C、E在冷浓H2SO4中发生钝化反应,由此可以推断A、 B、 C、 D、E依次为
A. Fe、Cu、Al、Ag、Mg B.Al、Cu、Mg、Ag、Fe
C. Mg、Cu、Al、Ag、Fe D.Mg、Ag、Al、Cu、Fe
C
解析试题分析:(3)C与强碱反应放出气体,则C是Al; (4)C、E在冷浓H2SO4中发生钝化反应,则E是Fe;(1)A、C均能与稀 H2SO4反应放出气体;则根据金属的活动性顺序可知A是Mg;(2)B与D的硝酸盐反应,置换出单质D,由于B两种金属是Cu、Ag ,由于活动性Cu>Ag 。活动性强的能把活动性弱的2置换出来。所以B是Cu;D是Ag。因此A、 B、 C、 D、E依次为Mg、Cu、Al、Ag、Fe。选项为C。
考点:考查金属元素的确定方法的知识。

 初中暑期衔接系列答案
初中暑期衔接系列答案下列关于碳酸钠和碳酸氢钠的说法不正确的是
| A.碳酸钠的热稳定性比碳酸氢钠强 |
| B.相同温度时,碳酸钠的溶解度大于碳酸氢钠 |
| C.同温度、同物质的量浓度时,碳酸钠溶液碱性大于碳酸氢钠溶液 |
| D.碳酸氢钠一定条件下可转化为碳酸钠,但碳酸钠不能转化为碳酸氢钠 |
下列现象或事实可用同一原理解释的是
| A.铁在冷的浓硫酸中和铝在冷的浓硝酸中都没有明显变化 |
| B.浓硫酸和浓盐酸长期暴露在空气中浓度降低 |
| C.SO2、漂白粉、活性炭、过氧化钠都能使红墨水褪色 |
| D.漂白粉和水玻璃长期暴露在空气中变质 |
为了验证小苏打中是否含有纯碱,下列实验操作及方法正确的是
| A.观察加热时是否放出气体 |
| B.观察滴加盐酸时能否放出气体 |
| C.溶于水中,再滴加石灰水,观察有无沉淀产生 |
| D.溶于水中,滴加少量的氯化钡溶液,观察有无白色沉淀产生 |
甲、乙、丙、丁为中学常见物质,其中甲、乙为单质,丙为氧化物,它们之间存在如图所示的转化关系。 下列说法正确的是
下列说法正确的是
| A.若甲、乙均为金属单质,则丁所属的物质类别一定是碱性氧化物 |
| B.若甲为金属单质,乙为非金属单质,则甲只能是Mg |
| C.若甲、乙元素是同主族元素,根据元素周期表推测,此时乙单质可能是Si |
| D.若甲、乙元素是同周期元素,则该反应的化学方程式一定为:2F2 + 2H2O=4HF + O2 |
某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案: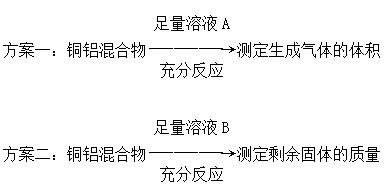
下列有关判断中不正确的是
| A.溶液A和溶液B均可以是盐酸或NaOH溶液 |
| B.若溶液B选用浓硝酸,测得铜的质量分数偏大 |
| C.方案一可能产生氢气,方案二可能剩余铜 |
| D.实验室中方案Ⅱ更便于实施 |
下列方法不能用于鉴别Na2CO3和NaHCO3固体的是
| A.分别加热两种固体,将放出的气体通入澄清石灰水 |
| B.分别取两种固体溶于水,滴加Ba(OH)2溶液,观察是否生成沉淀 |
| C.分别取两种固体各1 g,滴入几滴水振荡,用手触摸试管底部 |
| D.分别取等质量的固体与足量稀盐酸充分反应,加热、蒸干、灼烧称重 |
FeSO4可发生如图所示的一系列反应,下列说法错误的是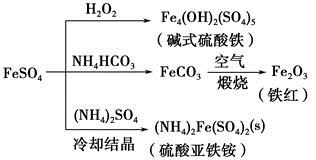
| A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用做净水剂 |
| B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 |
| C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 |
| D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大 |
将铝粉与Fe3O4粉末配制成铝热剂,分成三等份。
①一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为V1;
②一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为V2;
③一份直接放入足量的盐酸中,充分反应后放出气体在标准状况下的体积为V3。
下列说法正确的是 ( )。
| A.V1=V3>V2 | B.V2>V1=V3 |
| C.V1=V2>V3 | D.V1>V3>V2 |