题目内容
将5.4 g Al 投入到200mL 2.0 mol/L的某溶液中有氢气产生,充分反应后有金属剩余。该溶液可能为
| A.HNO3溶液 | B.Ba(OH)2溶液 | C.H2SO4溶液 | D.HCl溶液 |
D
解析试题分析:200.0mL 2.0mol?L-1的某溶液中溶质的物质的量为0.2L×2.0mol?L-1=0.4mol,Al的物质的量为5.4g÷27g/mol=0.2mol,A、因Al与HNO3溶液不生成氢气,则不符合题意,故A错误;B、由2Al+2OH-+2H2O=2AlO2-+3H2↑,0.2molAl与0.4molBa(OH)2溶液反应时,碱过量,故B错误;C、由2Al+6H+=2Al3++3H2↑,0.2molAl与0.4molH2SO4溶液反应,硫酸过量,故C错误;D、由2Al+6H+=2Al3++3H2↑,0.2molAl与0.4molHCl溶液反应,Al过量,故D正确,答案选D。
考点:考查铝与酸碱反应的有关计算

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关金属及其化合物的说法错误的是
| A.铁与水蒸气在高温条件下反应生成四氧化三铁和氢气 |
| B.稀硫酸中加入铜粉不反应,再加入硝酸钠仍不反应 |
| C.AlCl3、FeCl2、CuCl2均可通过化合反应制得 |
| D.饱和碳酸钠溶液中通人足量二氧化碳,溶液变浑浊 |
下列现象或事实可用同一原理解释的是
| A.铁在冷的浓硫酸中和铝在冷的浓硝酸中都没有明显变化 |
| B.浓硫酸和浓盐酸长期暴露在空气中浓度降低 |
| C.SO2、漂白粉、活性炭、过氧化钠都能使红墨水褪色 |
| D.漂白粉和水玻璃长期暴露在空气中变质 |
为了验证小苏打中是否含有纯碱,下列实验操作及方法正确的是
| A.观察加热时是否放出气体 |
| B.观察滴加盐酸时能否放出气体 |
| C.溶于水中,再滴加石灰水,观察有无沉淀产生 |
| D.溶于水中,滴加少量的氯化钡溶液,观察有无白色沉淀产生 |
足量的二氧化碳通入到1mol/L NaOH溶液中,下列说法错误的是
| A.溶液中Na+离子个数为NA(NA表示阿伏加德罗常数) |
| B.溶液中的CO32—离子浓度先增大后减小 |
| C.微热反应后的溶液,溶液的pH会升高 |
| D.当恰好生成Na2CO3时,溶液中离子浓度大小存在以下关系: |
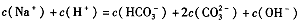
下列方法不能用于鉴别Na2CO3和NaHCO3固体的是
| A.分别加热两种固体,将放出的气体通入澄清石灰水 |
| B.分别取两种固体溶于水,滴加Ba(OH)2溶液,观察是否生成沉淀 |
| C.分别取两种固体各1 g,滴入几滴水振荡,用手触摸试管底部 |
| D.分别取等质量的固体与足量稀盐酸充分反应,加热、蒸干、灼烧称重 |
FeSO4可发生如图所示的一系列反应,下列说法错误的是
| A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用做净水剂 |
| B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 |
| C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 |
| D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大 |
下列关于钠及其化合物的说法正确的是( )。
| A.将金属钠投入水中,再经过一步转化可得碳酸氢钠 |
| B.分别向Na2CO3和NaHCO3溶液中滴加少量盐酸,产生CO2较快的为NaHCO3 |
| C.等物质的量的Na2O2、NaHCO3在密闭容器中加热,反应后得到的产物为纯净物 |
| D.钠与O2反应时,由于O2的量不同,可分别生成Na2O或Na2O2 |
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如下图所示)。下列说法错误的是( )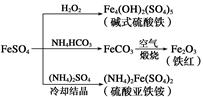
| A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂 |
| B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 |
| C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 |
| D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大 |