题目内容
4.化学是一门以实验为基础的学科,下列实验操作描述中正确的是①③⑤①为使稀硫酸和锌制取氢气的速率加快,可向稀硫酸中加入用铜丝网包裹的锌粒
②用托盘天平称取10.4g食盐时,将食盐放在右盘中的纸片上称量
③配制一定物质的量浓度的溶液时,容量瓶洗涤后未进行干燥,对实验结果无影响
④以酚酞作指示剂,用标准浓度的盐酸滴定NaOH溶液时,锥形瓶水洗后又用待测液润洗
⑤测定溶液的pH时,用洁净、干燥的玻璃棒蘸取待测溶液,点在试纸中部,待变色后与标准比色卡对照读数
⑥用标准浓度的盐酸滴定NaOH溶液时,滴定前仰视读数,滴定后俯视读数,这种操作将造成待测烧碱溶液浓度偏高.
分析 ①用铜丝网包裹的锌粒,比Zn的接触面积大,反应速率加快;
②食盐应放在左盘;
③容量瓶洗涤后未进行干燥,不影响溶质的物质的量;
④锥形瓶水洗后又用待测液润洗,待测液的物质的量偏大,消耗标准酸偏大;
⑤测定溶液的pH时,蘸取、滴在试纸上、对照比色卡即可;
⑥滴定前仰视读数,读数偏大;滴定后俯视读数,读数偏小,则标准酸的体积变小,计算得到的碱浓度偏小.
解答 解:①用铜丝网包裹的锌粒,比Zn的接触面积大,则稀硫酸和锌制取氢气的反应速率加快,故正确;
②称量时,固体放在作左盘中,食盐应放在左盘,则操作不合理,故错误;
③容量瓶洗涤后未进行干燥,不影响溶质的物质的量,对溶液的浓度无影响,故正确;
④锥形瓶水洗后又用待测液润洗,待测液的物质的量偏大,消耗标准酸偏大,所以测定结果偏大,故错误;
⑤测定溶液的pH时,蘸取、滴在试纸上、对照比色卡即可,测定pH的操作合理,故正确;
⑥滴定前仰视读数,读数偏大;滴定后俯视读数,读数偏小,则标准酸的体积变小,计算得到的碱浓度偏小,读数操持不合理,故错误;
故答案为:①③⑤.
点评 本题考查化学实验方案的评价,为高频考点,涉及知识点较多,侧重混合物分离提纯及实验基本操作及中和滴定实验的考查,注意方案的操作性、评价性分析,题目难度不大.

练习册系列答案
相关题目
14.设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是( )
| A. | 1 mol Cl2与足量Fe反应,转移的电子数为3NA | |
| B. | 3mol NO2与足量H2O反应,转移的电子数为NA | |
| C. | 0.1mol/L的氢氧化钠溶液中含钠离子数为0.1NA个 | |
| D. | 0.30mol Fe粉与足量水蒸气反应生成的H2分子数为0.40NA |
15. 二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇.已知氢气、甲醇燃烧的热化学方程式如下:
二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇.已知氢气、甲醇燃烧的热化学方程式如下:
①2H2(g)+O2(g)═2H2O(l)△H=-283.0 kJ/mol;
②2CH3OH(1)+3O2(g)═2CO2(g)+4H2O(l)△H=-726.0 kJ/mol.
(1)完成二氧化碳与氢气合成甲醇液体的热化学方程式:CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-61.5kJ/mol
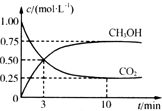
(2)为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0 kJ/mol测得CO2(g)和CH3OH(l)的浓度随时间的变化如图所示,平衡时CH3OH的体积分数为30%.
(3)已知反应2CH3OH?CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正>(填“>”、“<“或“=”)v逆;
②若加入CH3OH后,经10min反应达到平衡,该时间内反应速率v(CH3OH)=0.16 mol/(L•min).
(4)甲醇-空气燃料电池是利用稀土金属氧化物作为固体电解质,这种稀土金属氧化物在高温下能传导O2-.
①负极发生的反应是CH3OH-6e-+3O2-=CO2+2H2O;
②在稀土金属氧化物的固体电解质中,O2-的移动方向是A.(填字母)
A.从正极移向负极 B.从负极移向正极 C.从阳极移向阴极 D.从阴极移向阳极.
 二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇.已知氢气、甲醇燃烧的热化学方程式如下:
二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇.已知氢气、甲醇燃烧的热化学方程式如下:①2H2(g)+O2(g)═2H2O(l)△H=-283.0 kJ/mol;
②2CH3OH(1)+3O2(g)═2CO2(g)+4H2O(l)△H=-726.0 kJ/mol.
(1)完成二氧化碳与氢气合成甲醇液体的热化学方程式:CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-61.5kJ/mol
(2)为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0 kJ/mol测得CO2(g)和CH3OH(l)的浓度随时间的变化如图所示,平衡时CH3OH的体积分数为30%.
(3)已知反应2CH3OH?CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol/L) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,该时间内反应速率v(CH3OH)=0.16 mol/(L•min).
(4)甲醇-空气燃料电池是利用稀土金属氧化物作为固体电解质,这种稀土金属氧化物在高温下能传导O2-.
①负极发生的反应是CH3OH-6e-+3O2-=CO2+2H2O;
②在稀土金属氧化物的固体电解质中,O2-的移动方向是A.(填字母)
A.从正极移向负极 B.从负极移向正极 C.从阳极移向阴极 D.从阴极移向阳极.
12.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 标准状况下,4.48 L水中含有的分子数目为0.2NA | |
| B. | 1 mol•L-1 的CaCl2溶液中,含有氯离子数2NA | |
| C. | 23g Na与足量O2反应转移的电子数为NA | |
| D. | 1mol苯中含有“C=C”的数目为3NA |
19.能说明苯分子中的碳碳键不是单、双键交替,而是介于双键和单键之间的一种特殊的键的事实是( )
| A. | 甲苯无同分异构体 | B. | 间二甲苯没有同分异构体 | ||
| C. | 邻二甲苯没有同分异构体 | D. | 1 mol苯只能与3 molH2加成 |
9.下列指定反应的离子方程式正确的是( )
| A. | 用氨水吸收足量的SO2气体:2OH-+SO2═SO32-+H2O | |
| B. | NaAlO2溶液中AlO2-的水解:AlO2-+2H2O═Al(OH)3↓+OH- | |
| C. | 加入NaClO将污水中的NH3氧化成N2:3ClO-+2NH3═N2↑+3Cl-+3H2O | |
| D. | NaHCO3溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
16.实验室有下列试剂:①NaOH溶液 ②水玻璃 ③Na2S溶液④Na2CO3溶液⑤NH4Cl溶液⑥澄清的石灰水 ⑦浓硫酸,其中必须用带橡胶塞的试剂瓶保存的是( )
| A. | ①⑥ | B. | ①②③④⑥ | C. | ①②③⑥ | D. | ①②③④ |
16.能使酸性高锰酸钾溶液褪色的气体是( )
| A. | H2 | B. | CO2 | C. | SO2 | D. | CH4 |
 .
.