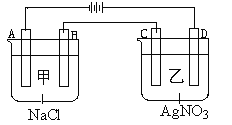
题目内容
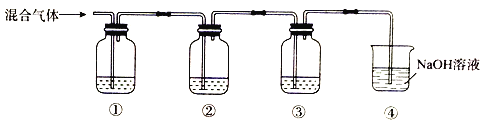
【题目】下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
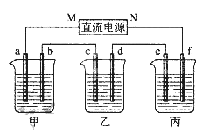
接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
(1)电源的N端为________极;
(2)电极b上发生的电极反应为:__________________,生成的气体在标准状况下的体积为__________L(保留两位有效数字);
(3)若要使乙溶液恢复到电解前的状态,可向乙溶液中加入________(填化学式),质量为________g(保留两位有效数字)。
【答案】 正极 4OH--4e-=2H2O + O2↑ 2.8L CuO或CuCO3 20g或31g
【解析】丙中电解K2SO4溶液,实质是电解水,所以溶质的量不变,设电解的水的质量为xg,则![]() ,x=4.5g n(H2O)=0.25mol,则电解过程中转移电子的物质的量为n(e-)=0.5mol。
,x=4.5g n(H2O)=0.25mol,则电解过程中转移电子的物质的量为n(e-)=0.5mol。
(1)由乙中c电极质量增加可知,c电极为阴极,所以电源的M端为负极,N端为正极;
(2)甲中电解氢氧化钠溶液,实质是水的电解,则阳极b上的电极反应为4OH--4e-=2H2O + O2↑,由电子转移守恒,求出氧气在标况下的体积为V(O2)= ![]() ;
;
(3)由电子转移守恒,求出乙中c电极上析出n(Cu)=0.25mol, d电极上析出n(O2)=0.25mol,所以需要加入m(CuO)=0.25mol×80g/mol=20g或m(CuCO3) =0.25mol×124g/mol=31g

 金钥匙试卷系列答案
金钥匙试卷系列答案【题目】
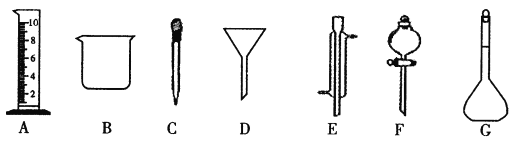
(1)写出仪器名称:E_____________,F_____________。
(2)下列实验操作中用到仪器D的是_________(选填下列选项的编号字母 )。
A.分离水和CC14的混合物 B.分离水和酒精的混合物 C.分离水和泥砂的混合物
Ⅱ.某课外兴趣小组需要200mL1mol/L的Na2CO3溶液,请回答下列问题:
(1)配制溶液所需仪器及药品:
应称取Na2CO3的质量 | 应选用容量瓶的规格 | 除容量瓶外还需要的其它玻璃仪器是上图中的______、_____及玻璃棒 |
(2)配制时,其正确的操作顺序是(用字母表示,每个操作只能用一次)______________。
A.将已冷却的溶液沿玻璃棒注入容量瓶中
B.用托盘天平准确称量所需Na2CO3的质量,倒入烧杯中,再加入适量水,用玻璃棒慢慢搅动,使其溶解(必要时可加热)
C.用适量水洗涤烧杯2-3次,洗涤液均注入容量瓶中,振荡
D.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
E.将容量瓶盖紧,振荡,摇匀
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?
没有进行C操作________;配制溶液时,容量瓶未干燥_________;定容时俯视刻度线_________。
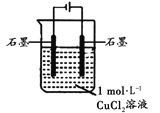
【题目】某小组同学利用下图装置对电解氯化铜实验进行了研究。
装置 | 现象 |
| 电解一段时间时,阳极石墨表面产生气体,阴极石墨上附着红色物质,烧杯壁变热,溶液由蓝色变为绿色 |
(1)甲认为电解过程中阳极产生的_________是溶液变绿的原因。
(2)乙查阅资料,CuCl2溶液中存在平衡:Cu2+ + 4Cl-![]() [CuCl4]2-(黄色) ΔH>0。据此乙认为:电解过程中,[CuCl4]2-(黄色)浓度增大,与CuCl2蓝色溶液混合呈绿色。乙依据平衡移动原理推测在电解过程中[CuCl4]2-浓度增大的原因:________________。
[CuCl4]2-(黄色) ΔH>0。据此乙认为:电解过程中,[CuCl4]2-(黄色)浓度增大,与CuCl2蓝色溶液混合呈绿色。乙依据平衡移动原理推测在电解过程中[CuCl4]2-浓度增大的原因:________________。
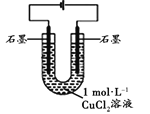
(3)丙改用下图装置,在相同条件下电解CuCl2溶液,对溶液变色现象继续探究。
装置 | 现象 |
| 电解相同时间时,阳极石墨表面产生气泡,溶液仍为蓝色;阴极石墨上附着红色物质,溶液由蓝色变为绿色;U型管变热,冷却后阴极附近溶液仍为绿色 |
丙通过对现象分析证实了甲和乙的观点均不是溶液变绿的主要原因。丙否定甲的依据是________,否定乙的依据是________________。
(4)丙继续查阅资料:
i. 电解CuCl2溶液时可能产生[CuCl2]-,[CuCl2]-掺杂Cu2+后呈黄色
ii. 稀释含[CuCl2]-的溶液生成CuCl白色沉淀据此丙认为:电解过程中,产生[CuCl2]-掺杂Cu2+后呈黄色,与CuCl2蓝色溶液混合呈绿色。
丙进行如下实验:
a.取电解后绿色溶液2 mL,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
b. 另取少量氯化铜晶体和铜粉,向其中加2 mL浓盐酸,加热获得含[CuCl2]-的黄色溶液。
c. 冷却后向上述溶液……
d. 取c中2 mL溶液,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
① a的目的是__________________。
② 写出b中生成[CuCl2]-的离子方程式:____________________。
③ 补充c中必要的操作及现象:____________________。
丙据此得出结论:电解时阴极附近生成[CuCl2]-是导致溶液变绿的原因。