题目内容
已知固体混合物A由NaHC03、KHC03、MgCO3、CaC03四种物质中的两种混合而成,通过计算和推理回答下列问题:
(1)取A与足量的盐酸反应
①若固体混合物A的物质的量n(A)为定值,生成气体的量即为定值,则A的组成最多可能有 种.
②若若固体混合物A的质量m(A)为定值,生成气体的量即为定值,则A的可能组成是 、 、 .(填化学式,可以不填满,也可以补充).
(2)若先将A加热,剩余固体再与足量的盐酸反应,且先后两次产生的气体分别通过足量的澄清的石灰水生成的沉淀均为10.Og,则n(A)= mol.
(1)取A与足量的盐酸反应
①若固体混合物A的物质的量n(A)为定值,生成气体的量即为定值,则A的组成最多可能有
②若若固体混合物A的质量m(A)为定值,生成气体的量即为定值,则A的可能组成是
(2)若先将A加热,剩余固体再与足量的盐酸反应,且先后两次产生的气体分别通过足量的澄清的石灰水生成的沉淀均为10.Og,则n(A)=
考点:几组未知物的检验,有关混合物反应的计算
专题:物质检验鉴别题,计算题
分析:(1)①若固体混合物A的物质的量n(A)为定值,生成气体的量即为定值,只要混合物中C原子的物质的量为定值即可;
②若若固体混合物A的质量m(A)为定值,生成气体的量即为定值,则混合物中各物质的式量相同;
(2)根据沉淀的质量求出二氧化碳的物质的量,再根据碳原子守恒计算A.
②若若固体混合物A的质量m(A)为定值,生成气体的量即为定值,则混合物中各物质的式量相同;
(2)根据沉淀的质量求出二氧化碳的物质的量,再根据碳原子守恒计算A.
解答:
解:(1)①若固体混合物A的物质的量n(A)为定值,生成气体的量即为定值,只要混合物中C原子的物质的量为定值即可,已知NaHC03、KHC03、MgCO3、CaC03四种物质中均含有一个碳原子,当任意两种物质混合时碳原子的物质的量均相同,则任意两种混合而成与盐酸反应生成的气体均相同,所以NaHC03、KHC03、MgCO3、CaC03四种物质任意两种混合时可以形成6种组合;
故答案为:6;
②若若固体混合物A的质量m(A)为定值,生成气体的量即为定值,则混合物中各物质的式量相同,NaHC03、KHC03、MgCO3、CaC03四种物质中MgCO3,NaHC03的式量均为84,KHC03,CaC03的式量均为100,所以若若固体混合物A的质量m(A)为定值,生成气体的量即为定值,则A的可能组成是MgCO3、NaHC03,KHC03,CaC03;
故答案为:MgCO3、NaHC03;KHC03,CaC03;
(2)若先将A加热,剩余固体再与足量的盐酸反应,且先后两次产生的气体分别通过足量的澄清的石灰水生成的沉淀均为10.Og,A受热分解生成二氧化碳则含有NaHCO3或KHC03,n(CaCO3)=
=0.1mol,则二氧化碳的物质的量为0.1mol,2NaHCO3
Na2CO3+H2O+CO2↑,则Na2CO3的物质的量为0.1mol,NaHCO3为0.2mol,0.1molNa2CO3与盐酸反应生成0.1mol二氧化碳,则说明原混合物中只含有碳酸氢盐一种,其物质的量为0.2mol;
故答案为:0.2.
故答案为:6;
②若若固体混合物A的质量m(A)为定值,生成气体的量即为定值,则混合物中各物质的式量相同,NaHC03、KHC03、MgCO3、CaC03四种物质中MgCO3,NaHC03的式量均为84,KHC03,CaC03的式量均为100,所以若若固体混合物A的质量m(A)为定值,生成气体的量即为定值,则A的可能组成是MgCO3、NaHC03,KHC03,CaC03;
故答案为:MgCO3、NaHC03;KHC03,CaC03;
(2)若先将A加热,剩余固体再与足量的盐酸反应,且先后两次产生的气体分别通过足量的澄清的石灰水生成的沉淀均为10.Og,A受热分解生成二氧化碳则含有NaHCO3或KHC03,n(CaCO3)=
| m |
| M |
| ||
故答案为:0.2.
点评:本题考查了碳酸盐的有关计算,题目难度中等,注意把握碳酸盐和碳酸氢盐性质的差别,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
下列有机物分子中,所有的原子不可能处于同一平面的是( )
| A、CH2=CH-CH=CH2 |
| B、CH2=CH-CH3 |
| C、CH2=CH2 |
| D、以上答案均不合理 |
下列物质按化合物、单质、混合物顺序排列的是( )
| A、肥皂水、白磷、石灰水 |
| B、烧碱、液氧、啤酒 |
| C、干冰、铜、液氯 |
| D、空气、氮气、盐酸 |
下列有关说法正确的是( )
| A、李比希法、钠熔法、铜丝灼烧法等都是定量研究有机物中元素组成的方法 |
| B、元素分析仪可用于分析有机物中的元素组成 |
| C、“钠熔法”的变化过程中钠必定发生还原反应 |
| D、根据1H核磁共振谱就可以确定任何有机物分子的结构 |
下列实验正确的是( )
A、 用酸性KMnO4溶液滴定Na2SO3溶液 |
B、 配制稀硫酸 |
C、 海带灼烧成灰 |
D、 探究氯碱工业原理 |
铅蓄电池负极:Pb+SO42-=PbSO4+2e- 正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O实验室用铅蓄电池作电源,用惰性电极电解CuSO4溶液,当阴极析出2.4g产物时,铅蓄电池内消耗H2SO4物质的量至少是( )
| A、0.2mol |
| B、2.4mol |
| C、0.075mol |
| D、0.05mol |
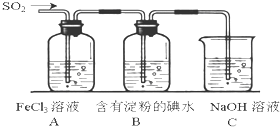 某校化学兴趣小组为探究SO2气体的还原性设计了如下装置图:
某校化学兴趣小组为探究SO2气体的还原性设计了如下装置图: