题目内容
15.在一定条件下,将NO2和O2的混合气体12mL通入足量水中,充分反应后剩余2mL气体(同温同压下),则原混合气体中氧气的体积为( )①1.2mL ②2.4mL ③3mL ④4mL.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
分析 若12mL全部为NO2,由3NO2+H2O=2HNO3+NO可知剩余气体为4mL,大于实际剩余气体2mL,故剩余气体为NO或氧气.
若剩余气体为氧气,根据4NO2+O2+2H2O=4HNO3计算参加反应二氧化氮、氧气体积,进而计算原混合气体中氧气体积;
若剩余气体为NO,根据3NO2+H2O=2HNO3+NO计算该反应中二氧化氮体积,进而计算4NO2+O2+2H2O=4HNO3反应中消耗二氧化氮、氧气总体积,结合二氧化氮与氧气按4:1反应计算氧气体积.
解答 解:若12mL全部为NO2,由3NO2+H2O=2HNO3+NO可知剩余气体为4mL,大于实际剩余气体2mL,故剩余气体为NO或氧气.
若剩余气体为氧气,则4NO2+O2+2H2O=4HNO3中参加反应二氧化氮、氧气体积总体积为12mL-2mL=10mL,则反应的氧气为10mL×$\frac{1}{5}$=2mL,故原混合气体中氧气体积为2mL+2mL=4mL;
若剩余气体为NO,根据3NO2+H2O=2HNO3+NO可知,该反应中二氧化氮体积为2mL×3=6mL,则4NO2+O2+2H2O=4HNO3反应中消耗二氧化氮、氧气总体积为12mL-6mL=6mL,则氧气体积为6mL×$\frac{1}{5}$=1.2mL,
故选:D.
点评 本题考查混合物计算,关键是分析剩余气体的成分,再根据反应的方程式计算,侧重考查学生分析计算能力,难度中等.

练习册系列答案
相关题目
5.钢铁发生吸氧腐蚀时,正极发生的反应是( )
| A. | 2H++2e-═H2↑ | B. | 2H2O+O2+4e-═4OH- | ||
| C. | Fe-3e═Fe3+ | D. | Fe-2e═Fe2+ |
6.研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1.则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1.
(2)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CH3OH的物质的量随时间的变化见图.

①曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为0.4<n(c)≤1.
③一定温度下,此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是bd.
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有6个H-H断裂.
(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1.则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1.
(2)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CH3OH的物质的量随时间的变化见图.

①曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
③一定温度下,此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是bd.
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有6个H-H断裂.
10.油轮在海上发生柴油泄漏后,收集到海水和柴油的混合物,则从该混合物中提取柴油的方法是( )
| A. | 萃取 | B. | 分液 | C. | 蒸馏 | D. | 过滤 |
20.下列各组离子在特定条件下能够大量共存的是( )
| A. | 在使石蕊试液变红的溶液中:Na+、NH4+、NO3-、AlO2- | |
| B. | 在含有较多Al3+的溶液中:Na+、K+、SO42-、HCO3- | |
| C. | 室温下,在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液中:K+、I-、Cl-、HS- | |
| D. | 在无色溶液中:SO42-、Cl-、NH4+、Na+ |
7.甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )


| A. | 丙与戊的原子序数相差28 | |
| B. | 气态氢化物的稳定性:庚<己<戊 | |
| C. | 常温下,庚和乙形成的化合物易溶于水 | |
| D. | 丁的最高价氧化物不与任何酸反应 |
2.如表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:①N,⑥Si,⑦S.
(2)画出原子的结构示意图:④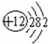 ,⑧
,⑧ ;
;
(3)在表中有编号的元素中,金属性最强的元素是K,非金属性最强的元素是F,用电子式表示它们形成化合物的过程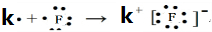 .最不活泼的元素是Ar.(以上均填元素名称)
.最不活泼的元素是Ar.(以上均填元素名称)
(4)元素③、⑩、的氢氧化物碱性由强到弱的顺序KOH>NaOH;元素⑥、⑦、⑧的氢化物稳定性由弱到强的顺序SiH4<H2S<HCl(均用化学式填空)
(5)周期中有一种元素,其最高价氧化物的水化物与同周期其它元素最高价氧化物的水化物所属物质类型都不同,用离子方程式表示该水化物分别与烧碱溶液和稀硫酸的反应:Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+=Al3++3H2O;.
(6)与①和⑥都相邻的一种元素A,它有多种不同形态的单质,其中一种常用作原电池的电极,它与⑦的最高价氧化物的水化物浓溶液在加热时能反应,写出化学反应方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(7)写出能验证⑦的非金属性强于A的化学反应的离子方程式:CO32-+2H+=CO2↑+H2O.
 | ⅠA | ⅡA | ⅢA | ⅠVA | VA | VⅠA | VⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ |
(2)画出原子的结构示意图:④
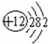 ,⑧
,⑧ ;
;(3)在表中有编号的元素中,金属性最强的元素是K,非金属性最强的元素是F,用电子式表示它们形成化合物的过程
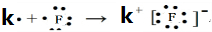 .最不活泼的元素是Ar.(以上均填元素名称)
.最不活泼的元素是Ar.(以上均填元素名称)(4)元素③、⑩、的氢氧化物碱性由强到弱的顺序KOH>NaOH;元素⑥、⑦、⑧的氢化物稳定性由弱到强的顺序SiH4<H2S<HCl(均用化学式填空)
(5)周期中有一种元素,其最高价氧化物的水化物与同周期其它元素最高价氧化物的水化物所属物质类型都不同,用离子方程式表示该水化物分别与烧碱溶液和稀硫酸的反应:Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+=Al3++3H2O;.
(6)与①和⑥都相邻的一种元素A,它有多种不同形态的单质,其中一种常用作原电池的电极,它与⑦的最高价氧化物的水化物浓溶液在加热时能反应,写出化学反应方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(7)写出能验证⑦的非金属性强于A的化学反应的离子方程式:CO32-+2H+=CO2↑+H2O.
3.某有机物其结构简式为 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )
 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )| A. | 不能使酸性KMnO4溶液褪色 | |
| B. | 不能使溴水褪色 | |
| C. | 在加热和催化剂作用下,最多能和3mol H2反应 | |
| D. | 一定条件下,不能和NaOH醇溶液反应 |