题目内容
12.下列说法不正确的是( )| A. | 已知①Fe(s)+$\frac{1}{2}$O2(g)═FeO(s)△H1=-272 kJ/mol;②2Al(s)+$\frac{3}{2}$O2(g)═Al2O3(s)△H2=-1675kJ/mol,则2Al(s)+3FeO(s)=Al2O3(s)+3Fe(s);△H=-859 kJ/mol | |
| B. | 25℃时,向10mL物质的量浓度均为0.10mol/LNaOH和NH3•H2O的混合溶液中,逐滴滴加 10mL0.10mol/L 盐酸,混合溶液中 c(NH4+)+c(H+)=c(OH-) | |
| C. | 25℃时,向0.10mol/LNaHSO3溶液中通入NH3至溶液PH=7(体积变化忽略),则有:c(Na+)>c(NH4+)>c(SO32-) | |
| D. | 比较Na2S2O3溶液与不同浓度稀硫酸反应速率的快慢是通过测定出现黄色沉淀的快慢来比较的,而不是采用排水法测量单位时间内气体体积的大小进行比较的 |
分析 A.①Fe(s)+$\frac{1}{2}$O2(g)═FeO(s)△H1=-272.0kJ•mol-1;
②2Al(s)+$\frac{3}{2}$O2(g)═Al2O3(s)△H2=-1675kJ•mol-1;
依据盖斯定律计算②-①×3得到:3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-859KJ/mol,据此进行分析;
B.根据电荷守恒c(NH4+)+c(H+)+c(Na+)=c(OH-)+c(Cl-),10mL物质的量浓度为0.10mol/LNaOH,c(Na+)=0.10mol/L,10mL0.10mol/L 盐酸,c(Cl-)=0.10mol/L,则c(Na+)=c(Cl-),故 c(NH4+)+c(H+)=c(OH-)据此进行分析;
C.向0.10mol/LNaHSO3溶液中通入NH3,至溶液pH=7,反应生成Na2SO3和(NH4)2SO3,SO32-与NH4+水解程度相同,据此进行分析;
D.根据二氧化硫的溶解性强,1体积水能溶解40体积二氧化硫.
解答 解:A.①Fe(s)+$\frac{1}{2}$O2(g)═FeO(s)△H1=-272.0kJ•mol-1;
②2Al(s)+$\frac{3}{2}$O2(g)═Al2O3(s)△H2=-1675kJ•mol-1;
依据盖斯定律计算②-①×3得到:3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-859KJ/mol,故A正确;
B.根据电荷守恒c(NH4+)+c(H+)+c(Na+)=c(OH-)+c(Cl-),10mL物质的量浓度为0.10mol/LNaOH,c(Na+)=0.10mol/L,10mL0.10mol/L 盐酸,c(Cl-)=0.10mol/L,则c(Na+)=c(Cl-),故 c(NH4+)+c(H+)=c(OH-),故B正确;
C.向0.10mol/LNaHSO3溶液中通入NH3,至溶液pH=7,反应生成Na2SO3和(NH4)2SO3,SO32-与NH4+水解程度相同,则c(Na+)>c(NH4+)=c(SO32-),故C错误;
D.二氧化硫可以溶于水,1体积水能溶解40体积二氧化硫,所以导致测定不精确,且该实验装置较复杂,不易控制,所以不采用排水法测量单位时间内气体体积的大小进行比较,故D正确,
故选C.
点评 本题考查化学方程式的书写,离子浓度大小的判断,注意电荷守恒的应用,以及二氧化硫的溶解性强的应用,本题难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案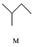 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$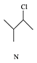 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$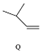 ,下列说法正确的是( )
,下列说法正确的是( )| A. | M的名称为异丁烷 | |
| B. | N的同分异构体有7种(不考虑立体异构,不包括本身) | |
| C. | Q可与溴水反应生成N | |
| D. | M、N、Q均能使酸性KMnO4溶液褪色 |
请回答下列问题:
(l)对青蒿进行破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素的浸取率.
(2)操作I用到的玻璃仪器是漏斗、玻璃棒、烧杯,操作Ⅱ的名称是蒸馏.
(3)用图2实验装置测定青蒿素的化学式,将28.2g青蒿素放在燃烧管C中充分燃烧:

①仪器各接口的连接顺序从左到右依次为afgdebchi(每个装置限用一次).A装置中发生的化学反应方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
②装置C中CuO的作用是使青蒿素充分氧化生成CO2和H2O.
③装置D中的试剂为浓硫酸.
④已知青蒿素是烃的含氧衍生物,用合理连接后的装置进行实验.测量数据如表:
| 装置质量 | 实验前/g | 实验后/g |
| B | 22.6 | 42.4 |
| E(不含干燥管) | 80.2 | 146.2 |
(4)某学生对青蒿素的性质进行探究.将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解度较小,加热并搅拌,青蒿素的溶解度增大,且溶液红色变浅,与青蒿素化学性质相似的物质是C(填字母代号).
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖.
| A. | 双氧水、高锰酸钾溶液可以杀菌消毒,其消毒原理和漂白粉消毒饮用水相同 | |
| B. | PM2.5 指环境空气中空气动力学当量直径小于等于 2.5 微米的颗粒物,属于胶体 | |
| C. | 焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| D. | 汽油、煤油、植物油都是油,但它们的主要成分不相同 |
| A. | Fe3O4、CuO | B. | C、CuO | C. | Fe、MnO2 | D. | Si、FeS |
| A. | pH计不能用于酸碱中和滴定终点的判断 | |
| B. | 利用太阳能等淸洁能源代替化石燃料,有利于节约资源、保护环境 | |
| C. | 糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同 | |
| D. | 葡萄中的花靑素在碱性环境下显蓝色,故可用苏打粉检验假红酒 |
| A. | 0.1 mol/L | B. | 0.2 mol/L | C. | 0.3 mo/L | D. | 0.4 mo/L |
| A. | c(N2):c(H2):c(NH3)=1:3:2 | |
| B. | 2v(H2)=3v(NH3) | |
| C. | 单位时间内1个N≡N键断裂的同时,有6个N-H键断裂 | |
| D. | 单位时间消耗0.1molN2的同时,生成0.2molNH3 |