题目内容
【题目】某温度下,在一密闭容器中发生如下可逆反应:![]() ;
;![]() 若起始时E浓度为a
若起始时E浓度为a![]() ,F、G浓度均为0,达平衡时E浓度为0.5a
,F、G浓度均为0,达平衡时E浓度为0.5a![]() ;若E的起始浓度改为2a
;若E的起始浓度改为2a![]() ,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是
,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是
A.升高温度时,正反应速率加快、逆反应速率减慢
B.若![]() ,容器体积保持不变,新平衡下E的体积分数为
,容器体积保持不变,新平衡下E的体积分数为![]()
C.若![]() ,容器体积保持不变,新平衡下F的平衡浓度小于
,容器体积保持不变,新平衡下F的平衡浓度小于![]()
![]()
D.若![]() ,容器压强保持不变,新平衡下E的物质的量为amol
,容器压强保持不变,新平衡下E的物质的量为amol
【答案】B
【解析】
A、升高温度正、逆反应速率都增大;
B、容器体积保持不变,![]() ,反应前后气体的物质的量不变,若E的起始浓度改为2a
,反应前后气体的物质的量不变,若E的起始浓度改为2a![]() ,等效为增大压强,平衡不移动,新平衡下E的体积分数与原平衡相等;
,等效为增大压强,平衡不移动,新平衡下E的体积分数与原平衡相等;
C、容器体积保持不变,若E的起始浓度改为2a![]() ,等效为在原平衡的基础上增大E的浓度,反应向正反应进行,F的浓度增大;
,等效为在原平衡的基础上增大E的浓度,反应向正反应进行,F的浓度增大;
D、题目中为物质的量的浓度,不能确定物质具体物质的量.
A、升高温度正、逆反应速率都增大,故A错误;
B、容器体积保持不变,![]() ,反应前后气体的物质的量不变,若E的起始浓度改为2a
,反应前后气体的物质的量不变,若E的起始浓度改为2a![]() ,等效为增大压强,平衡不移动,平衡时E的转化率不变,新平衡下E的体积分数与原平衡相等为
,等效为增大压强,平衡不移动,平衡时E的转化率不变,新平衡下E的体积分数与原平衡相等为![]() ,故B正确;
,故B正确;
C、原平衡时E浓度为0.5a![]() ,
,![]() mol/L-0.5amol/L=0.5a
mol/L-0.5amol/L=0.5a![]() ,故平衡时F的浓度为0.5a
,故平衡时F的浓度为0.5a![]() ,容器体积保持不变,若E的起始浓度改为2a
,容器体积保持不变,若E的起始浓度改为2a![]() ,等效为在原平衡的基础上增大E的浓度,反应向正反应进行,F的浓度增大,故大于0.5a
,等效为在原平衡的基础上增大E的浓度,反应向正反应进行,F的浓度增大,故大于0.5a![]() ,故C错误;
,故C错误;
D、容器压强保持不变,若E的起始浓度改为2a![]() ,与原平衡为等效平衡,E的转化率相同,平衡时E的物质的量为原平衡的2倍,题目中为物质的量的浓度,不能确定物质的量,原平衡E的物质的量不一定是
,与原平衡为等效平衡,E的转化率相同,平衡时E的物质的量为原平衡的2倍,题目中为物质的量的浓度,不能确定物质的量,原平衡E的物质的量不一定是![]() ,故D错误;
,故D错误;
故选B。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案【题目】—定温度下,向10mL0.40mol/LH2O2 溶液中加入少量FeCl3溶液(忽略整个过程中溶液体积的变化),不同时刻测得生成O2的体积(已折算为标准状况下)如表所示:
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0 | 9.9 | 17.5 | 22.4 |
资料显示,反应分两步进行:①2Fe3++H2O2=2Fe2++2H++O2;②H2O2+2Fe2++2H+=2H2O+2Fe3+。反应过程中能量变化如图所示。下列说法正确的是

A. Fe2+的作用是增大过氧化氢的分解速率
B. 反应①、②均是放热反应
C. 反应2H2O2(aq)=2H2O(l)+O2(g)是吸热反应
D. 0~6min内的平均反应速率v(H2O2)=3.33×10-2mol/(L·min)
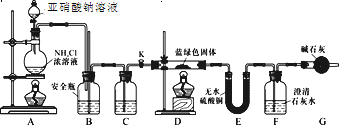
【题目】雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)氮、氧元素非金属性较强的是_____。(用元素符号回答)
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:
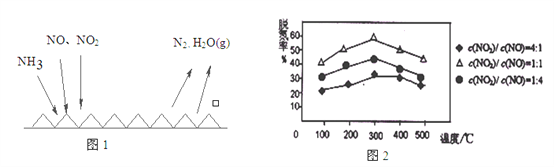
①由图1可知SCR技术中的氧化剂为:_________________。
②用Fe做催化剂时,在氨气足量的情况下,不同c(NO)/c(NO2)对应的脱氮率如图2所示,效果最佳的c(NO)/ c(NO2)=_________。
(3)硝酸厂常用如下烧碱吸收法处理氦氧化物(NO与NO2)尾气。氮氧化物(NO与NO2)用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积的25%NaOH溶液(密度1.28g/cm3)完全吸收。已知反应后溶液中含有0.35mo1NaNO2。则尾气中NO与NO2的物质的量之比为______。(已知:2NO2+2NaOH=NaNO3+NaNO2+H2O、NO+NO2+2NaOH=2NaNO2+H2O)
(4)现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的稀硝酸[假设反应中稀硝酸的还原产物只有NO),产生气体在标准状况下的体积与剩余固体的质量如下表:
硝酸体枳(mL) | 100 | 200 | 300 | 400 |
剩余固体(g) | 18.0 | 9.6 | 0 | 0 |
放出气体的体积(mL) | 2240 | 4480 | 6720 |
计算原混合物中铁和铜的物质的量比为_______________。
【题目】在相同温度和压强下,对反应CO2(g)+H2(g)![]() CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
| CO2 | H2 | CO | H2O |
甲 | amol | amol | 0mol | 0mol |
乙 | 2amol | amol | 0mol | 0mol |
丙 | 0mol | 0mol | amol | amol |
丁 | amol | 0mol | amol | amol |
上述四种情况达到平衡后,n(CO)的大小顺序是
A. 乙=丁>丙=甲B. 乙>丁>甲>丙
C. 丁>乙>丙=甲D. 丁>丙>乙>甲