题目内容
4.已知t℃、101kPa时容积可变的密闭容器中充入2molA和1molB,此时容器的体积为V L,发生反应2A(g)+B(g)?2C(g),达平衡时,C的体积分数是0.4.(1)若恒温恒压时,开始充入4molC,达平衡时C的体积分数是0.4,容器的体积为$\frac{5}{3}$VL.
(2)若另选一容积不变的密闭容器,仍控制温度为t℃,开始充入4molA和2molB,反应达平衡时C的体积分数是0.4,压强为101kPa.则该容器的体积为$\frac{5}{3}$VL.
(3)若控制温度为t℃,另选一容积不变的密闭容器,其体积为VL,开始充入一定量的A和B,达到平衡时C的体积分数仍是0.4,则开始充入的A和B物质的量应满足 a<$\frac{{n}_{A}}{{n}_{B}}$<b,其中a为0.5,b为5.
分析 令原平衡时中,参加反应的B为amol,利用三段式表示出平衡时各组分的物质的量,再根据C的体积分数列方程计算,利用体积之比等于物质的量之比计算达到平衡时容器的容积,
(1)恒温恒压下,往上述平衡体系中充入4molC,相当于再加入4molA、2molB,与原平衡中A、B的物质的量之比相等,故与原平衡为相等平衡,平衡时C的体积分数不变;所到达的平衡,等效为开始加入4molA、2molB,到达新平衡时,故混合气体总的物质的量为原平衡2倍,再体积之比等于物质的量之比计算达到新平衡时容器的容积;
(2)恒温恒容下,使4molA和2molB反应,达到平衡时Z的体积分数仍为0.4,与原平衡为相等平衡,容器体积等于开始加入4molA和2molB在恒温恒压下建立平衡时的体积,再结合(1)中的分析计算;
(3)依据恒温恒压条件和恒温恒容条件下达到相同的平衡,结合化学平衡的三段式列式得到金属关系,根据极端假设法进行讨论:计算得到起始量的物质的量之比.
解答 解:(1)令原平衡时中,参加反应的B为amol,则:
2A(g)+B(g)?2C(g)
开始(mol):2 1 0
变化(mol):2a a 2a
平衡(mol):2-2a 1-a 2a
所以,$\frac{2a}{2-2a+1-a+2a}$=0.4,解得a=0.5,故平衡时,容器的体积=V L×$\frac{3-a}{3}$=$\frac{5}{6}$V L,
恒温恒压下,往上述平衡体系中充入4molC,相当于再加入4molA、2molB,与原平衡中A、B的物质的量之比相等,故与原平衡为等效平衡,平衡时C的体积分数不变为0.4;所到达的平衡,等效为开始加入4molA、2molB,到达新平衡时,混合气体总的物质的量为原平衡2倍,故达到新平衡时容器的容积=$\frac{5}{6}$V L×2=$\frac{5}{3}$V L,
故答案为:0.4;$\frac{5}{3}$V;
(2)恒温恒容下,使4molA和2molB反应,达到平衡时C的体积分数仍为0.4,与原平衡为相等平衡,容器体积等于开始加入4molA和2molB在恒温恒压下建立平衡时的体积,故到达新平衡时,混合气体总的物质的量为原平衡2倍,故容器的容积=$\frac{5}{6}$V L×2=$\frac{5}{3}$V L,
故答案为:$\frac{5}{3}$V;
(3)设起始时,A和B的物质的量分别为n(A)和n(B),发生转化的B的物质的量为x,则
2A(g)+B(g)=2C(g)
起始/mol:n(A) n(B) 0
转化/mol:2x x 2x
平衡/mol:n(A)-2x n(B)-x 2x
根据“平衡混合气体中C的体积分数仍为0.4”列等式:
解得n(A)+n(B)=6x ①
下面用极端假设法进行讨论:
若A完全转化,则生成的C为:
2x=n(A) ②
由①②两式得:2n(A)=n(B)
若B完全转化,则生成的C为:
2x=2n(B) ③
由①③两式得:n(A)=5n(B)
综上所述:$\frac{1}{2}$<$\frac{n(A)}{n(B)}$<5,
则a=0.5,b=5,
故答案为:0.5;5.
点评 本题考查等效平衡的有关计算,理解等效平衡规律、构建等效平衡建立的途径是解题的关键,难度中等.


| A. |  | B. |  | ||
| C. |  | D. |  |
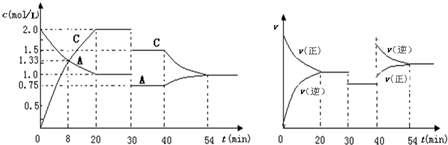
| A. | 0~20min用A物质表示反应的平均速率为0.005mol•L-1•min-1 | |
| B. | 该反应的正反应为吸热反应 | |
| C. | x=1,且30min时改变的反应条件是减压 | |
| D. | 在25min、35min、55min时化学平衡常数分别为K1、K2、K3,则K3>K2>K1 |
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 上述反应为X+3Y?2Z,其平衡常数为1600 | |
| C. | 增大压强使平衡向生成Z的方向移动,平衡常数不变 | |
| D. | 若改变温度反应的平衡常数变大,则一定为升高温度 |
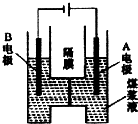 用惰性电极电解煤浆液的方法制H2的反应为C(s)+2H2O(l)=CO2(g)+2H2(g).现将一定量的1mol/LH2SO4溶液和适量煤粉充分混合,制成含碳量为0.02g/mL~0.12g/mL的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极).下列说法错误的是( )
用惰性电极电解煤浆液的方法制H2的反应为C(s)+2H2O(l)=CO2(g)+2H2(g).现将一定量的1mol/LH2SO4溶液和适量煤粉充分混合,制成含碳量为0.02g/mL~0.12g/mL的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极).下列说法错误的是( )| A. | A极是阳极,B极为阴极 | |
| B. | A极的电极反应式为C+2H2O-4e-=CO2↑+4H+ | |
| C. | B极的电极反应式为2H++2e-=H2↑ | |
| D. | 电解一段时间后,煤浆液的pH增大 |
| A. | 物质所含元素化合价升高的反应叫还原反应 | |
| B. | 在氧化还原反应中,失去电子的元素化合价降低 | |
| C. | 物质中某元素失去电子,则此物质是氧化剂 | |
| D. | 还原剂中必定有一种元素被氧化 |
| A. | 向碳酸氢钙溶液中加入过量氢氧化钠:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | |
| B. | 等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O+H2O | |
| C. | 氢氧化铝与足量盐酸反应:Al(OH)3+3H+=Al3++3H2O | |
| D. | 过量CO2通入氢氧化钠溶液中:CO2+2OH-=CO32-+H2O |
| A. | 铝热法冶炼难熔金属 | B. | 实验室用NH4Cl和Ca(OH)2制备NH3 | ||
| C. | Na2O2用作呼吸面具的供氧剂 | D. | 工业上电解熔融状态Al2O3制备Al |