题目内容
已知BeCl2为共价化合物。 下列对于BeCl2分子的说法正确的是
| A.由极性键构成的极性分子 | B.由非极性键构成的非极性分子 |
| C.由非极性键构成的极性分子 | D.由极性键构成的非极性分子 |
D
解析试题分析: 极性键主要存在于不同非金属元素之间,非极性键主要存在于相同非金属元素之间.故BeCl2由极性键构成,但它们结构是对称结构,故是非极性分子。
考点:考查化学键的相关知识点。

练习册系列答案
相关题目
某学生在做元素性质与原子结构关系的实验时,设计了一套实验方案,并记录了有关的实验现象。请帮助该学生整理并完成实验报告。
(1)实验目的
探究同一主族元素性质的递变规律。
(2)实验用品
仪器:试管、胶头滴管
药品:新制氯水、新制溴水、溴化钠溶液、碘化钠溶液、四氯化碳
(3)实验内容(在下表横线中填写相关内容)
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制氯水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈_____色 |
| ② | 向盛有少量碘化钠溶液的试管中滴加少量新制溴水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈_____色 |
(4)实验结论:_________________________________。
(5)问题和讨论
①上述两个实验中发生反应的离子方程式分别为________________、__________________。
②由于氟单质过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱。试列举两项事实说明氟的非金属性比氯的强:______________、______________。
下列各元素的原子在形成不同物质时,既能形成非极性键,也能形成极性键,还能形成离子键的是( )。
| A.Na | B.Fe | C.C | D.Ne |
下列说法正确的是
| A.碘化铵和氯化铵受热分解过程中破坏和形成的化学键类型完全相同 |
| B.反应N2H4(l)=N2(g)+2H2(g)是一个△S>0的反应 |
| C.1 mol FeCl3完全水解得到的Fe(OH)3胶体中胶粒数目为NA(NA为阿伏加德罗常数) |
| D.HClO是弱酸,所以NaClO是弱电解质 |
在以离子键为主的化学键中常含有共价键的成分。下列各组原子形成化学键中共价键成分最少的是( )
| A.Li,F | B.Na,Cl | C.Na,F | D.Mg,O |
下列物质中,中心原子的杂化类型为sp3杂化的是
| A.C2H6 | B.C2H2 | C.BF3 | D.C2H4 |
下列各组微粒属于等电子体的是( )
| A.CO和CO2 | B.NO和NO2 | C.CH4和NH3 | D.CO2和N2O |
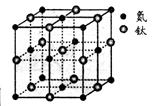
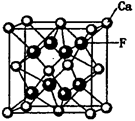
 存在,使晶胞沿一个方向拉长,则CaC2晶体中1个C
存在,使晶胞沿一个方向拉长,则CaC2晶体中1个C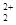 互为等电子体,O
互为等电子体,O