题目内容
11.下列叙述中,正确的是( )| A. | G4H10的一种同分异构体只能生成一种一氯代物 | |
| B. | CH3-CH=CH-C≡C-CF3分子结构中6个碳原子不可能都在一条直线上 | |
| C. | 某物质的名称为:2-甲基-3-乙基丁烷 | |
| D. | 制取1,2-二溴乙烷的最合理的方法是乙烯与HBr进行加成反应 |
分析 A、C4H10的一种同分异构体中一氯代物的种数即为等效氢原子数目;
B、分子中含有甲基、C=C、C≡C,结合甲烷为正四面体结构、乙烯为平面型结构、乙炔为直线型结构来解答;
C、烷烃的命名遵循:最长、最小、最近的原则;
D、乙烯与HBr进行加成反应得到的是溴乙烷.
解答 解:A、C4H10的2种同分异构体:正丁烷、异丁烷,一氯代物的种数分别是2、2,故A错误;
B、分子中碳链空间结构为平面型,如图所示 ,故所有6个碳原子不可能都在同一直线上,故B正确;
,故所有6个碳原子不可能都在同一直线上,故B正确;
C、2-甲基-3-乙基丁烷中,3号位不能是乙基,选择的碳链不是最长的,故C错误;
D、制取1,2-二溴乙烷的最合理的方法是乙烯与溴水进行加成反应,故D错误.
故选B.
点评 本题主要考查了同分异构体的书写、常见有机物的结构、有机物的制备等知识,做题时注意从甲烷、乙烯、苯和乙炔的结构特点判断有机分子的空间结构.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
1.现有失去标签的氯化镁、碳酸钠、硫酸氢钠、氢氧化钡四种无色溶液,为了确定四种溶液各是什么,将它们随意编号A、B、C、D后进行实验,其实验现象如表
根据实验现象,按要求回答:
(1)写出各物质的化学式ABa(OH)2、BNaHSO4、CNa2CO3、DMgCl2
(2)写出实验中反应②的离子方程式2H++CO32-=CO2↑+H2O向A中滴加少量的B的离子方程式H++SO42-+OH-+Ba2+=BaSO4↓+H2O,继续滴加的离子方程式H++OH-=H2O.
| 反应编号 | 反应物质 | 有关现象 |
| ① | A+B | 有沉淀生成 |
| ② | B+C | 有气体放出 |
| ③ | C+D | 有沉淀生成 |
| ④ | B+D | 无明显现象 |
| ⑤ | A+D | 有沉淀生成 |
(1)写出各物质的化学式ABa(OH)2、BNaHSO4、CNa2CO3、DMgCl2
(2)写出实验中反应②的离子方程式2H++CO32-=CO2↑+H2O向A中滴加少量的B的离子方程式H++SO42-+OH-+Ba2+=BaSO4↓+H2O,继续滴加的离子方程式H++OH-=H2O.
19.下列有关氧族元素的叙述中,正确的是( )
| A. | 都能生成+6价化合物 | B. | 原子的最外层电子数都是6 | ||
| C. | 都能生成稳定的氢化物 | D. | 单质在通常情况下均为固体 |
16.下列说法正确的是( )
| A. | 0.2mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-) | |
| B. | 向NH4Cl溶液中加入少量氨水,当pH=7时,则混合液中:c(NH4+)=c(Cl-) | |
| C. | 0.1mol•L-1的Na2S溶液中:c(Na+)=2c(S2-) | |
| D. | 某溶液的pH为6,则该溶液一定显酸性 |
20.常温下,下列溶液的离子浓度关系式正确的是( )
| A. | pH=6的H2S溶液中,c(H+)=c(HS-)=1×10-6mol•L-1 | |
| B. | pH=a的醋酸溶液,稀释10倍后,其pH=b,则b=a+1 | |
| C. | pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液pH<7:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | pH相同的①CH3COONa、②Na2CO3、③NaClO三种溶液的c(Na+):①<②<③ |
19.工业合成氨与制备硝酸一般可连续生产,流程如图1所示:

(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果).
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g);△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1<573K(填“>”、“<”或“=”).
(3)N2和H2以铁作催化剂从145℃就开始反应,不同温度下NH3的产率如图2所示.温度高于900℃时,NH3产率下降的原因是温度高于900℃时,平衡向左移动
(4)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2=(g)═4NO(g)+CO2(g)+2H2O(g);△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+N2(g)△H=-867kJ/mol
(5)氨气在纯氧中燃烧,生成一种单质和水.科学家利用此原理,设计成氨气-氧气燃料电池,则在碱性条件下通入氨气发生的电极反应式为2NH3+6OH--6e-=N2+6H2O.

(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果).
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g);△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1<573K(填“>”、“<”或“=”).
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(4)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2=(g)═4NO(g)+CO2(g)+2H2O(g);△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+N2(g)△H=-867kJ/mol
(5)氨气在纯氧中燃烧,生成一种单质和水.科学家利用此原理,设计成氨气-氧气燃料电池,则在碱性条件下通入氨气发生的电极反应式为2NH3+6OH--6e-=N2+6H2O.
 如图为某原电池装置:
如图为某原电池装置: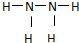 ,过氧化氢的电子式
,过氧化氢的电子式 .
.
 ,C的化学式Cl2.
,C的化学式Cl2.