题目内容
12.下表列出了A-R九种元素在周期表中的位置,用元素符号或化学式填空.主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
化学性质最不活泼的是Ar;
金属性最强的是K;
最高价氧化物的水化物碱性最强的碱是KOH;
最高价氧化物的水化物酸性最强的酸是HClO4.
(2)D元素的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
(3)A、B、C三种元素按原子半径由大到小的顺序排列的为K>Na>Mg.
(4)F的氢化物的电子式
 ;G、H 氢化物的稳定性递减的顺序是HCl>HBr.
;G、H 氢化物的稳定性递减的顺序是HCl>HBr.(5)H元素跟A元素形成的化合物的化学式是NaBr;A2F2的电子式是
 ;.
;.(6)B和F两种元素形成的2:1型化合物属于离子化合物(填“离子化合物”或“共价化合物”),请用电子式表示其形成过程
 .
.
分析 由元素在周期表的位置可知,A、B、C、D、E、F、G、H、R分别为Na、K、Mg、Al、C、O、Cl、Br、Ar,
(1)以上几种元素,稀有气体的性质最不活泼,K的金属性最强,Cl的最高价氧化物的水化物酸性最强;
(2)D元素的最高价氧化物对应的水化物与氢氧化钠溶液反应,生成偏铝酸钠和水;
(3)电子层越多,半径越大,同周期原子序数大的半径小;
(4)F的氢化物为H2O,非金属性越强,气态氢化物越稳定;
(5)H元素跟A元素形成的化合物为离子化合物溴化钠,A2F2为Na2O2;
(6)B和F两种元素形成的2:1型化合物为K2O,为离子化合物.
解答 解:由元素在周期表的位置可知,A、B、C、D、E、F、G、H、R分别为Na、K、Mg、Al、C、O、Cl、Br、Ar,
(1)以上几种元素,Ar的性质最不活泼,K的金属性最强,最高价氧化物的水化物碱性最强的碱是KOH,最高价氧化物的水化物酸性最强的为HClO4,
故答案为:Ar;K;KOH;HClO4;
(2)D元素的最高价氧化物对应的水化物与氢氧化钠溶液反应,生成偏铝酸钠和水,离子反应为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)电子层越多,半径越大,同周期原子序数大的半径小,原子半径由大到小的顺序排列为K>Na>Mg,故答案为:K>Na>Mg;
(4)F的氢化物为H2O,其电子式为 ,非金属性Cl>Br,气态氢化物稳定性为HCl>HBr,故答案为:
,非金属性Cl>Br,气态氢化物稳定性为HCl>HBr,故答案为: ;HCl>HBr;
;HCl>HBr;
(5)H元素跟A元素形成的化合物为离子化合物溴化钠,其化学式为NaBr,A2F2为Na2O2,其电子式为 ,
,
故答案为:NaBr; ;
;
(6)B和F两种元素形成的2:1型化合物为K2O,为离子化合物,其形成过程为 ,
,
故答案为:离子化合物; .
.
点评 本题考查位置、结构、性质的关系及应用,为高频考点,把握元素的位置及性质为解答的关键,侧重考查元素化合物性质及化学用语,题目难度不大.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | C和Mg | B. | Si和Na | C. | Cl和C | D. | B和He |
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol(中和热数值为57.3kJ/mol).
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).实验中测得起始温度与终止温度的平均温差为4.0℃则中和热△H=-53.5kJ/mol(取小数点后一位).用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小.(填“偏大”、“偏小”、“无影响”)
(3)X、R是短周期主族元素,X、R在周期表中的相对位置如表所示;X元素最低负化合价的绝对值等于其原子的最外层电子数; 已知由X和R形成的液态化合物XR2的燃烧热是1075kJ/mol,试写出表示其燃烧热的热化学方程式CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol.写出化合物XR2的结构式S=C=S.
| X | ||||
| R |
| A. | 第一电离能:Y可能大于或小于X | |
| B. | 气态氢化物的稳定性:HmY强于HnX | |
| C. | 最高价含氧酸的酸性X强于Y | |
| D. | X和Y形成化合物时,X显负价Y显正价 |
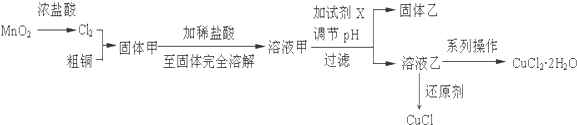
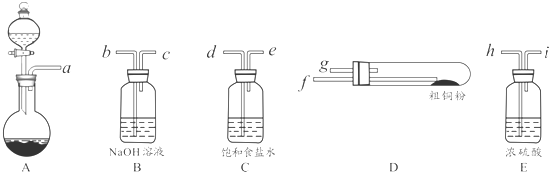
 用甲烷、甲醇、乙醇、甲醚等可以制成燃料电池.实验室中,若以甲醇燃料电池为直流电源,以一定浓度的乙醛和 Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其原理是乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,其装置示意图如图所示.
用甲烷、甲醇、乙醇、甲醚等可以制成燃料电池.实验室中,若以甲醇燃料电池为直流电源,以一定浓度的乙醛和 Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其原理是乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,其装置示意图如图所示.