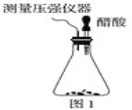
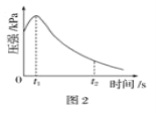
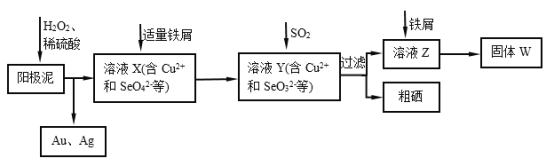
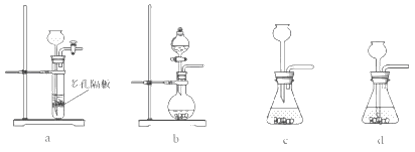
题目内容
【题目】300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g) ![]() 2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
(1)300 ℃时,该反应的平衡常数表达式为:K =__________。已知K300 ℃<K350 ℃,则ΔH______0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为________,D的平均反应速率为________。
(3)若温度不变,缩小容器容积,则A的转化率______(填“增大”“减小”或“不变” ) ,原因是 _______。
(4)如果在相同的条件下,上述反应从逆反应方向进行,开始时加入C、D各![]() mol。欲使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B_________mol。
mol。欲使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B_________mol。
【答案】[c2(C).c2(D)]/[c3(A).c(B)] > 0.8 mol/L 0.2 mol/(L·min) 不变 反应前后气体体积不变,压强对平衡无影响 4/3 .
【解析】
根据题意可知,本题考查化学平衡常数、化学反应速率、转化率、等效平衡的计算,依据化学平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积、 ,平衡移动与转化率关系分析。
,平衡移动与转化率关系分析。

(1)化学平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则 ,
,
K300 ℃<K350 ℃,说明升高温度平衡向正反应方向移动,则正反应放热,△H>0,
故答案为: ;>;
;>;
(2)由上述计算可知,平衡时B的物质的量为1.6mol,所以B的平衡浓度为![]() ,平衡时D的物质的量为0.8mol,所以用D表示的平均反应速率为
,平衡时D的物质的量为0.8mol,所以用D表示的平均反应速率为 ,
,
故答案为:0.8mol/L;0.2mol/(L·min);
(3)由方程式可知,气体的化学计量数之和前后相等,则反应前后气体体积不变,压强对平衡无影响,缩小容器容积,则A的转化率不变,
故答案为:不变;反应前后气体体积不变,压强对平衡无影响;
(4)为等效平衡,应前后气体体积不变,按化学计量数转化到左边,满足n(A):n(B)=1:1即可根据3A(g)+B(g)![]() 2C(g)+2D(g)可知,C和D各号
2C(g)+2D(g)可知,C和D各号![]() mol,转化到左边可得A.2mol, B.
mol,转化到左边可得A.2mol, B. ![]() mol,令B的物质的量为nmol,则:2mol:
mol,令B的物质的量为nmol,则:2mol: ![]() mol=2mol:2mol,解得n=
mol=2mol:2mol,解得n=![]() ,
,
故答案为:![]() 。
。

【题目】某探究小组利用丙酮的溴代反应(CH3COCH3+Br2![]() CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率 v(Br2) 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率 v(Br2) 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
实验序号 | 初始浓度c/mol·L-1 | 溴颜色消失所需时间t/s | ||
CH3COCH3 | HCl | Br2 | ||
① | 0.80 | 0.20 | 0.0010 | 290 |
② | 1.60 | 0.20 | 0.0010 | 145 |
③ | 0.80 | 0.40 | 0.0010 | 145 |
④ | 0.80 | 0.20 | 0.0020 | 580 |
分析实验数据所得出的结论不正确的是( )
A.增大c(CH3COCH3),v(Br2)增大
B.实验②和③的v(Br2)相等
C.增大c(HCl),v(Br2)增大
D.增大c(Br2),v(Br2)增大