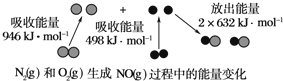
题目内容
电动车采用了一种高效耐用的新型可充电电池,该电池的总反应式为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH.
①该电池放电时负极反应式为 .
②放电时每转移3mol电子,正极有 mol K2FeO4被还原.
| 充电 |
| 放电 |
①该电池放电时负极反应式为
②放电时每转移3mol电子,正极有
考点:化学电源新型电池
专题:
分析:①放电时,负极上锌失电子发生氧化反应;
②放电时,正极上1molK2FeO4得3mol电子发生还原反应生成1molFe(OH)3.
②放电时,正极上1molK2FeO4得3mol电子发生还原反应生成1molFe(OH)3.
解答:
解:①放电时,负极上锌失电子发生氧化反应,电极反应式为:Zn-2e-+2OH-═Zn(OH)2,故答案为:Zn-2e-+2OH-═Zn(OH)2;
②放电时,正极上1molK2FeO4得3mol电子发生还原反应生成1molFe(OH)3,所以每转移3 mol电子,正极有1molK2FeO4被还原,故答案为:1.
②放电时,正极上1molK2FeO4得3mol电子发生还原反应生成1molFe(OH)3,所以每转移3 mol电子,正极有1molK2FeO4被还原,故答案为:1.
点评:本题考查电解池与原电池,明确电极反应中放电为原电池、充电为电解池时解答本题的关键,题目难度不大.

练习册系列答案
相关题目
常温下,在溶液中可发生以下反应:①2Fe2++Br2═2Fe3++2Br-②2Br-+Cl2═Br2+2Cl-③2Fe3++2I-═2Fe2++2I2由此判断下列说法正确的是( )
| A、铁元素在反应①和③中均被氧化 |
| B、Fe2+在氧化还原反应中只能做还原剂 |
| C、还原性强弱顺序为:I->Br->Fe2+>Cl- |
| D、反应③中当有2molFe3+ 被还原时,有2mol I-被氧化 |
下列有关化学用语的表示正确的是( )
A、质量数为37的氯原子:
| ||
B、二氧化碳分子的比例模型: | ||
C、NH4Br的电子式: | ||
D、对羟基苯甲醛的结构简式: |
常温下,下列有关醋酸的叙述中不正确的是( )
| A、Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) |
| B、将pH=a的醋酸稀释为pH=a+1的过程中,c(OH-)不断增大 |
| C、等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,a+b=14 |
| D、浓度均为0.1 mol-1的CH3COOH溶液和氨水等体积混合后:c(CH3COO-)+c(OH-)=c(NH4+)+c(H+) |
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )
| X | Y | |
| Z | W |
| A、原子半径:W>Z>Y>X |
| B、最高价氧化物对应水化物的酸性:Z>W>X |
| C、气态氢化物的沸点:Y>Z |
| D、四种元素的单质中,W单质的熔、沸点最高 |
现将足量的AgCl固体分别放入下列物质中,所得溶液中c(Ag+)最小是( )
| A、10 mL 0.2mol?L-1MgCl2溶液 |
| B、20 mL 0.5 mol?L-1 AgNO3溶液 |
| C、40 mL 0.3mol?L-1HCl溶液 |
| D、15 mL 0.1mol?L-1 AlCl3溶液 |