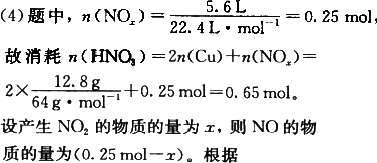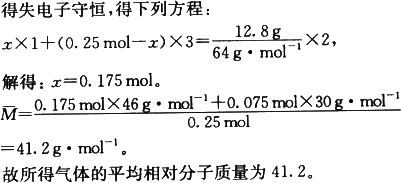题目内容
在浓硝酸中放入铜片:
(1)开始反应的化学方程式为________,实验现象为________.
(2)若铜有剩余,则反应将要结束时的化学方程式是________.
(3)待反应停止后,再加入少量质量分数为25%的稀硫酸,这时铜片上又有气泡产生,其原因是________.
(4)若将12.8 g铜跟一定量的浓硝酸反应,铜耗完时,共产生气体5.6 L(标准状况).则所消耗的硝酸的物质的量是________,所得气体的平均相对分子质量为________.
答案:
解析:
解析:
|
答案:(1)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;溶液逐渐变蓝,有红棕色气体逸出,铜片不断溶解. (2)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O. (3)加入稀H2SO4,提供H+,与原溶液中的 (4)0.65 mol;41.2. 解析:(2)题中随着反应的进行,硝酸浓度不断减小,故反应后阶段发生的是铜与稀HNO3的反应.
评注:尽管稀硫酸不与Cu反应,但在稀硝酸与Cu反应后的溶液中含 |

练习册系列答案
相关题目