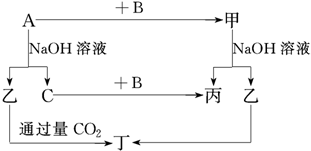
题目内容
15.高铁酸钠(Na2FeO4)是一种高效多功能水处理剂,应用前景十分看好.一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2 +O2↑,对此反应下列说法中正确的是① 处的物质为Na2SO4; ②Na2FeO4既是氧化产物又是还原产物;
③Na2O2既是氧化剂又是还原剂; ④2molFeSO4发生反应时,反应共转移8mol电子( )
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
分析 由质量守恒可知反应方程式为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,反应中Fe元素化合价升高,FeSO4为还原剂,反应中Na2O2的O元素化合价既升高又降低,则Na2O2既是氧化剂又是还原剂,结合元素化合价的变化计算转移电子的数目.
解答 解:①.由质量守恒可知圆括号内的物质为Na2SO4,故①正确;
②.FeSO4→Na2FeO4,Fe的化合价升高,Na2FeO4是氧化产物,Na2O2→Na2FeO4,O元素化合价降低,Na2FeO4是还原产物,故②正确;
③.反应中生成O2,Na2O2的O元素化合价既升高又降低,则Na2O2既是氧化剂又是还原剂,故③正确;
④.2 mol FeSO4发生反应时,生成2molNa2FeO4,转移8mol电子,同时生成1molO2,反应中共有10mol电子转移,故④错误;
故选A.
点评 本题考查氧化还原反应,题目难度不大,注意从元素化合价变化的角度判断物质的性质,易错点为④,注意反应过氧化钠既是氧化剂又是还原剂.

练习册系列答案
相关题目
5.下列说法中正确的是( )
| A. | 氯化钠水溶液在电流的作用下电离出Na+和Cl- | |
| B. | 硫酸钡难溶于水,但硫酸钡属于强电解质 | |
| C. | 二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质 | |
| D. | 硫酸氢钠在水中的电离方程式可表示为NaHSO4═Na++HSO4- |
10.2003年3月,美英联军在伊拉克遭遇沙尘暴.沙尘暴已成为世界环境问题中的一个重点问题,下列措施可以防止沙尘暴的是( )
| A. | 植树造林,加强绿化 | B. | 合理使用化肥和农药 | ||
| C. | 工业“三废”经处理后再排放 | D. | 矿物产品的综合开发和利用 |
20.下列说法中正确的是( )
| A. | KClO3和SO3溶于水后能导电,故KClO3和SO3均为电解质 | |
| B. | 升高温度能够增大单位体积内活化分子百分数,从而加快反应速率 | |
| C. | 中和热测定实验中需要用到的玻璃仪器有烧杯、温度计和量筒三种 | |
| D. | 强电解质的导电能力一定比弱电解质强 |
7.下列各组说法一定正确的是( )
| A. | 强电解质:盐酸、氢氧化钡、明矾 | |
| B. | 纯净物:冰水混合物;含氧40%的氧化镁 | |
| C. | 有单质参加和单质生成的化学反应一定是氧化还原反应 | |
| D. | 同位素:H2、D2、T2 |
4.如图所示是物质间发生化学反应的颜色变化,下列选项中正确的是( )


| 选项 | M | N | P |
| A | NH3•H2O | Ba(OH)2 | Cu |
| B | Na | BaCl2 | FeO |
| C | NaOH | Ba(NO3)2 | Fe |
| D | Na2O | MgCl2 | Fe |
| A. | A | B. | B | C. | C | D. | D |
5.下列有关实验装置进行的相应实验,不能达到实验目的是( )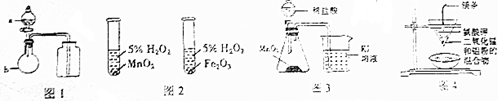
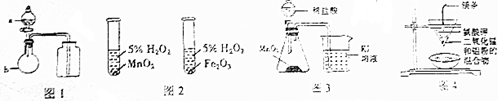
| A. | 用图1所示装置进行浓硫酸与亚硫酸钠的反应制取并收集SO2 | |
| B. | 用图2所示装置进行研究不同催化剂对反应速率的影响 | |
| C. | 用图3所示装置比较MnO2、Cl2、I2的氧化性 | |
| D. | 用图4所示装置可以制取金属锰 |