题目内容
醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,下列叙述中不正确的是( )
| A、升高温度时H+浓度增大 |
| B、加水稀释时平衡向右移动 |
| C、加入少量NaOH时溶液pH减小 |
| D、溶液中水电离出的H+浓度等于OH-浓度 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.升高温度促进弱电解质电离;
B.加水稀释促进弱电解质电离;
C.加入NaOH固体时,发生中和反应导致c(H+)减小;
D.酸溶液中水电离出的H+浓度等于OH-浓度.
B.加水稀释促进弱电解质电离;
C.加入NaOH固体时,发生中和反应导致c(H+)减小;
D.酸溶液中水电离出的H+浓度等于OH-浓度.
解答:
解:A.醋酸电离是吸热反应,升高温度促进醋酸电离,所以溶液中氢离子浓度增大,故A正确;
B.加水稀释促进醋酸电离,则电离平衡向右移动,故B正确;
C.加入NaOH固体时,发生中和反应导致c(H+)减小,溶液的pH增大,故C错误;
D.根据H2O?H++OH-知,醋酸溶液中水电离出的H+浓度等于OH-浓度,故D正确;
故选C.
B.加水稀释促进醋酸电离,则电离平衡向右移动,故B正确;
C.加入NaOH固体时,发生中和反应导致c(H+)减小,溶液的pH增大,故C错误;
D.根据H2O?H++OH-知,醋酸溶液中水电离出的H+浓度等于OH-浓度,故D正确;
故选C.
点评:本题考查弱电解质电离及弱电解质电离影响因素,注意只有改变温度时,电离平衡常数才改变,物质浓度与电离平衡常数无关,易错选项是D,会计算酸溶液中由水电离出氢离子浓度,为易错点.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
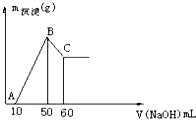 把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol?L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示,下列叙述不正确的是( )
把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol?L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示,下列叙述不正确的是( )| A、盐酸的物质的量浓度为0.5mol?L-1 |
| B、合金中铝的物质的量为0.01mol |
| C、合金中镁的物质的量为0.005mol |
| D、B点与C点沉淀的物质的量之比为2:1 |
“活化分子”是衡量化学反应速率快慢的重要依据,下列对“活化分子”的说法中不正确的是( )
| A、能够发生有效碰撞的分子一定是活化分子 |
| B、增大反应物的浓度,可使单位体积内活化分子数增多,反应速率加快 |
| C、增大压强,可使单位体积内活化分子数百分数增多,反应速率加快 |
| D、催化剂能降低分子活化时所需能量,使单位体积内活化分子百分数大大增加 |
沼气是一种能源,它的主要成分是CH41.6gCH4完全燃烧生成CO2和液态水时,放出89kJ热量,则下列热化学方程式中正确的是( )
| A、CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=+890kJ?mol-1 | ||||
| B、CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890kJ?mol-1 | ||||
| C、CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ?mol-1 | ||||
D、
|
下列有关金属的说法正确的是( )
| A、金属原子的核外电子在金属晶体中都是自由电子 |
| B、金属晶体是由金属阳离子和自由电子通过金属键而形成 |
| C、金属原子在化学变化中失去的电子数越多,其还原性越强 |
| D、金属导电的实质是金属阳离子在外电场作用下的定向移动 |
配制250mL 0.10mol/L的NaOH溶液时,下列实验操作会使配得的溶液中NaOH物质的量浓度偏大的是( )
| A、转移溶液后未洗涤烧杯和玻璃棒就直接定容 |
| B、溶解后立即转移至容量瓶 |
| C、在容量瓶中定容时俯视刻度线 |
| D、定容后把容量瓶倒置摇匀,发现液面低于刻度线,又补足了所缺的水 |
下列实验所用装置正确的是( )

| A、用甲图装置制备气体实现“随开随制,随关随停” |
| B、用乙图装置制取乙炔 |
| C、用丙图装置制备氢氧化亚铁 |
| D、用丁图装置制取乙烯 |
在光照条件下,甲烷与氯气反应得到的有机产物是( )
①CH3Cl ②CH2Cl2 ③CHCl3 ④CCl4.
①CH3Cl ②CH2Cl2 ③CHCl3 ④CCl4.
| A、只有① |
| B、只有② |
| C、①和②的混合物 |
| D、①②③④的混合物 |
下列实验操作与安全事故处理正确的是( )
| A、做H2还原CuO的实验时,为防止H2爆炸,实验完毕,应先停止通H2,再停止加热 | ||
| B、配制稀硫酸溶液时,先在量筒加入一定体积的水,再沿容器壁慢慢加入浓硫酸,并不断搅拌 | ||
C、用试管夹从试管底由下往上夹住距离管口约
| ||
| D、分液漏斗在使用前要检漏,使用过程中要适当旋开活塞放气 |