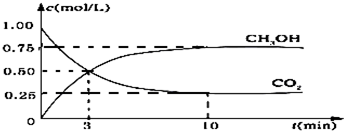
题目内容
在相同条件下N2H4?H2O的电离程度大于N2H5C1的水解程度,常温下,若将0.1mol/L N2H4?H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H+5、Cl-、OH-、H+离子浓度由大到小的顺序为 .
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:将0.1mol/L N2H4?H2O溶液与0.1mol/L HCl溶液等体积混合,得到溶质为N2H5C1,N2H+5离子在溶液中水解,溶液显酸性,即c(OH-)<c(H+)、根据电荷守恒可得c(N2H+5)<c(Cl-),据此判断各离子浓度大小.
解答:
解:将0.1mol/L N2H4?H2O溶液与0.1mol/L HCl溶液等体积混合,两溶液恰好反应,生成溶液中的溶质为N2H5C1,
由于N2H+5离子在溶液中部分水解,溶液显酸性,即c(OH-)<c(H+)、根据电荷守恒可知:c(N2H+5)<c(Cl-),
所以溶液中离子浓度大小为:c(Cl-)>c(N2H+5)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(N2H+5)>c(H+)>c(OH-).
由于N2H+5离子在溶液中部分水解,溶液显酸性,即c(OH-)<c(H+)、根据电荷守恒可知:c(N2H+5)<c(Cl-),
所以溶液中离子浓度大小为:c(Cl-)>c(N2H+5)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(N2H+5)>c(H+)>c(OH-).
点评:本题考查了溶液中离子浓度大小比较,题目难度中等,注意掌握判断溶液中离子浓度大小的方法,明确电荷守恒、盐的水解原理的应用,试题培养了学生的分析、理解能力.

练习册系列答案
相关题目
图象是一种简洁表示化学变化过程的方法,下列相关反应的图象中错误的是( )
A、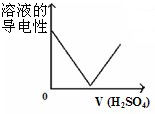 将一定量稀硫酸滴入到同浓度的Ba(OH)2溶液中 将一定量稀硫酸滴入到同浓度的Ba(OH)2溶液中 |
B、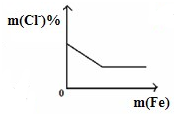 将铁粉加入到一定量FeCl3溶液中 将铁粉加入到一定量FeCl3溶液中 |
C、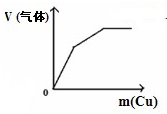 将铜粉加入到一定量浓硝酸中 将铜粉加入到一定量浓硝酸中 |
D、 将二氧化碳通入到一定量漂粉精溶液中 将二氧化碳通入到一定量漂粉精溶液中 |
100mL 1mol?L-1的AlCl3溶液中,逐渐滴入2mol?L-1 NaOH溶液,得到3.12g沉淀,则加入的NaOH溶液的体积是( )
①180mL ②200mL ③60mL ④120mL.
①180mL ②200mL ③60mL ④120mL.
| A、①② | B、②③ | C、①③ | D、③④ |
下列物质的分离或鉴别正确的是( )
| A、除去混在氯化钠固体中的氯化铵或单质碘,均可用升华的方法 |
| B、若FeCl2溶液中含有I-杂质,可用过量的Cl2氧化后进行萃取分液 |
| C、CO2中含有HCl杂质:通入饱和NaHCO3溶液,洗气 |
| D、鉴别固体Na2CO3和NaHCO3,可以分别配成溶液,再加入澄清石灰水 |