题目内容
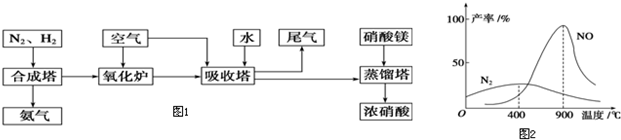
合成氨工业中焦炭、水、空气为原料制取氨气,生成过程中消耗的焦炭与所生成的氨气之间的物质的量之比为
- A.1∶1
- B.1∶2
- C.2∶3
- D.3∶4

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案| N2+O2═2NO | N2+3H2═2NH3 | |||
| 温度 | 25℃ | 2000℃ | 25℃ | 400℃ |
| 平衡常数K | 3.84×10-31 | 0.1 | 5×108 | 200 |
(2)工业合成氨原料气的制备主要方法如下:
(1)以空气为原料制备N2,其方法是
(2)以焦炭和水为原料制备H2,反应原理为
H2中混有的CO可用醋酸亚铜氨溶液吸收,以防止合成氨时催化剂中毒:CO(g)+Cu(NH3)2Ac(aq)═Cu(NH3)2AC?CO(aq)+Q(Q>0);要从除杂后的溶液中“再生”出醋酸亚铜氨,可
(3)液氨和水类似,也能自离解(电离):NH3+NH3═NH4++NH2-.
①液氨的离子积可以表示为
②25℃时,液氨的离子积K=1.0×10-30.若将NaNH2固体加入液氨中,则所得溶液中不存在的关系式是(设温度保持不变)
a.c(Na+)=c(NH2-) b.c(NH4+)?c(NH2-)=1.0×10-30 c.c(NH2-)>c(NH4+)
(4)若在液氨中NaNH2和NH4Cl都能完全电离,则用标准NaNH2液氨溶液滴定未知浓度NH4Cl液氨溶液时,反应的离子方程式为
| |||||||||||||||
大气固氮和合成氮是周氮的重要形式。下表是大气固氮和合成氨的部分K值:
|
|
N2+O2 |
N2+3H2 |
||
|
温度 |
25℃ |
2000℃ |
25℃ |
400℃ |
|
平衡常数K |
3.84×10-31 |
0.1 |
5×108 |
200 |
(1)大气固氮是_______(“吸热”、“放热”)反应;人工固氮对农业意义十分重大,根据表中数据,可推知合成氨最重要的研究方向是______________________________________。
(2)工业合成氨原料气的制备主要方法如下:
①以空气为原料制备N2,其方法是______________________________________。
②以焦炭和水为原料制备H2,反应原理为____________________、__________________。
H2中混有的CO可用醋酸亚铜氨溶液吸收,以防止合成氨时催化剂中毒:
CO(g)+Cu(NH3)2Ac(aq)  Cu(NH3)2AC·CO(aq)+Q(Q>0)
Cu(NH3)2AC·CO(aq)+Q(Q>0)
要从除杂后的溶液中“再生”出醋酸亚铜氨,可________(“升”“降”)温、____(“增”“降”)压。
(3)液氨和水类似,也能自离解(电离):NH3+NH3 NH4++NH2-。
NH4++NH2-。
①液氨的离子积可以表示为________________。
②25℃时,液氨的离子积K=1.0×10-30。若将NaNH2固体加入液氨中,则所得溶液中不存在的关系式是(设温度保持不变)_________ (选填编号)
a.c(Na+)=c(NH2-) b.c(NH4+)·c(NH2-)=1.0×10-30 c.c(NH2-)> c(NH4+)
(4)若在液氨中NaNH2和NH4Cl都能完全电离,则用标准NaNH2液氨溶液滴定未知浓度NH4Cl液氨溶液时,反应的离子方程式为_______________________。