题目内容
(16分,每空2分)已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

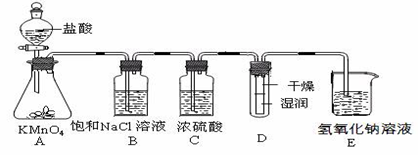
(1)装置A的分液漏斗中盛装的试剂是 ,烧瓶中的化学反应方程式 。
(2)装置B所加试剂饱和NaCl溶液,其装置的作用是 。
(3)装置C中盛放的试剂是 (选填下列所给试剂的代码),实验现象为 ,
该反应的离子方程式是 。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸比硫酸酸性强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气加热生成三氯化铁,铁与硫加热生成硫化亚铁;⑦硫原子与氯原子电子层数相同,氯原子半径小于硫原子。可说明氯比硫非金属性强的是
A.全部 B.②③④⑥⑦ C.①②④⑤⑥ D.除 ①以外
(5)装置D中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气,写出反应的离子方程式 。

(1)装置A的分液漏斗中盛装的试剂是 ,烧瓶中的化学反应方程式 。
(2)装置B所加试剂饱和NaCl溶液,其装置的作用是 。
(3)装置C中盛放的试剂是 (选填下列所给试剂的代码),实验现象为 ,
该反应的离子方程式是 。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸比硫酸酸性强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气加热生成三氯化铁,铁与硫加热生成硫化亚铁;⑦硫原子与氯原子电子层数相同,氯原子半径小于硫原子。可说明氯比硫非金属性强的是
A.全部 B.②③④⑥⑦ C.①②④⑤⑥ D.除 ①以外
(5)装置D中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气,写出反应的离子方程式 。
(16分)(1)浓盐酸 
(2) 除去Cl2中的HCl气体
(3)A ; 有淡黄色沉淀生成或者溶液变浑浊 ; S2-+Cl2=2Cl-+S↓ (4)B
(5) Cl2+ 2OH_ ="==" Cl- + ClO- + H2O

(2) 除去Cl2中的HCl气体
(3)A ; 有淡黄色沉淀生成或者溶液变浑浊 ; S2-+Cl2=2Cl-+S↓ (4)B
(5) Cl2+ 2OH_ ="==" Cl- + ClO- + H2O
(1)为验证氯元素的非金属性比硫元素的非金属性强,需要用氯气置换出硫,则必须用装置A制备氯气,实验室通常用浓盐酸与二氧化锰反应制取氯气,则A装置中A的分液漏斗中盛装的试剂是浓盐酸,烧瓶中加入的试剂是MnO2.故答案为:浓盐酸;
(2)由于用浓盐酸制取氯气,且需要加热,即实验过程中要挥发出HCl气体,因此B应是除去HCl气体的装置,除去Cl2中的HCl气体;
(3)要在C中发生氯气置换出硫的反应,在给定试剂中只能选取Na2S溶液,发生的是置换反应,化学方程式为:Na2S+Cl2=2NaCl+S↓。故答案为:A;有淡黄色沉淀生成;
(4)比较非金属性强弱的九条依据。元素在周期表中的相对位置;非金属单质与氢气化合的越容易,非金属性越强;气态氢化物的越稳定,非金属性越强;最高价氧化物对应的水化物的酸性越强,非金属性越强;非金属性强的元素的单质能置换出非金属性弱的元素的单质;非金属单质对应阴离子的还原性越强,该非金属元素的非金属性越弱;与变价金属反应时,金属所呈价态越高,非金属性越强;几种非金属同处于一种物质中,可用其化合价判断非金属性的强弱;能量:非金属元素原子得电子放热,放热越多离子越稳定,非金属越强。
我们可从最高价氧化物对应水化物的酸性强弱、与氢气反应的难以程度、气态氢化物的稳定性等来判断元素非金属性的强弱,对Cl和S来说,可具体为:HCl的稳定性比H2S的稳定性强或者HClO4的酸性比H2SO4的酸性强。

练习册系列答案
相关题目