题目内容
3.合成尿素的反应为完成下列填空:(1)写出NH3的电子式
 ;画出碳原子结构示意图
;画出碳原子结构示意图 ;氧元素位于周期表第周期第VIA族.
;氧元素位于周期表第周期第VIA族.(2)上述反应所涉及的4种元素,原子半径从大到小的排列顺序为C>N>O>H.
(3)上述反应所涉及的4种元素中,非金属性最强的是O.
(4)一定条件下,在10L的恒容密闭容器中,充入2mol NH3和1mol CO2,反应经5min后达到平衡,测得容器中水蒸气0.6mol,则平均反应速率v(NH3)=0.024mol/(L•min).
(5)下列能说明上述反应已达平衡的是bd.(填序号)
a.2c(NH3)=c(H2O) b.CO2的浓度不变
c.v正(NH3):v正(CO2)=2:1 d.气体的压强不变
(6)为提高氨气的转化率,工业上用该反应生产尿素时,合适的反应条件是ad.(填序号)
a.200℃b.800℃c.101kPad.24000kPa.
分析 (1)先判断化合物类型,然后根据共价化合物的电子式的表示方法写出电子式;碳元素的原子核内质子数是6,核外电子分2层排布,第一层2个第二层6个;氧元素位于第Ⅵ主族;
(2)原子半径大小比较:电子层越多,半径越大,电子层数一样,核电荷数越多,半径越小;
(3)同周期元素从左到右元素的得电子能力逐渐增强;
(4)平均反应速率v(NH3)=$\frac{△c}{△t}$,据此计算即可;
(5)根据化学平衡状态的标志:正反应速率等于逆反应速率,平衡混合物中各组成成分的含量不变来判断;
(6)为提高氨气的转化率,采用使得化学平衡正向移动的措施即可.
解答 解:(1)NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,氨气的电子式为 ,碳元素的原子核内质子数是6,核外电子分2层排布,第一层2个第二层6个,所以其原子结构示意图为:
,碳元素的原子核内质子数是6,核外电子分2层排布,第一层2个第二层6个,所以其原子结构示意图为:
 氧元素是8号元素,位于周期表中的第二周期,第VIA,故答案为:
氧元素是8号元素,位于周期表中的第二周期,第VIA,故答案为: ;
; ; 二;VIA;
; 二;VIA;
(2)原子半径大小比较:电子层越多,半径越大,电子层数一样,核电荷数越多,半径越小,尿素中四种元素N、O、N、H的原子半径大小顺序是:C>N>O>H,故答案为:C>N>O>H;
(3)上述反应所涉及的尿素中的四种元素N、O、N、H中,非金属性最强的是O,故答案为:O;
(4)根据反应:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l),反应经5min后达到平衡,测得容器中水蒸气0.6mol,则消耗氨气的物质的量是1.2mol,平均反应速率v(NH3)=$\frac{\frac{1.2mol}{10L}}{5min}$=0.024mol/(L•min).故答案为:0.024;
(5)a、化学方程式的系数之比等于化学反应中各物质的反应速率之比,2c(NH3)=c(H2O),均为正反应速率,不能判断是否达到平衡明反应得到平衡状态,故a错误;
b、CO2的浓度不变,说明正逆反应速率相等,反应达到平衡状态,故b正确;
c、化学方程式的系数之比等于化学反应中各物质的反应速率之比,v正(NH3):v正(CO2)=2:1,均为正反应速率,不能判断是否达到平衡明反应得到平衡状态,故c错误;
d、反应前后气体的系数和不同,所以气体的压强不变得状态是平衡状态,故d正确;
故选bd;
(6)为提高氨气的转化率,采用使得化学平衡正向移动的措施即可,工业上用该反应生产尿素时,合适的反应条件是高温高压,故选ad.
故答案为:ad.
点评 本题涉及元素周期律的应用、化学反应速率和平衡移动原理的应用、平衡状态的判断等方面的知识,属于综合知识的考查,难度中等.

 阶梯计算系列答案
阶梯计算系列答案| 选项 | 实验事实 | 结论 |
| A | H2可在Cl2中燃烧 | 燃烧不一定有氧气参加 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 氧化铝熔点高于铝 |
| C | 钠块投入水中,迅速熔成银白色小球 | 钠的密度比水小 |
| D | 某溶液中加入NaOH溶液,加热,产生使湿润红色石蕊试纸变蓝的气体 | 原溶液中含NH4+ |
| A. | A | B. | B | C. | C | D. | D |
| A. | 用灼烧的方法鉴别羊毛线和棉线 | |
| B. | 分馏石油时,温度计的水银球必须插入液面下 | |
| C. | 做银镜反应实验后,试管壁上的银镜用硝酸洗涤 | |
| D. | 沾附在试管内壁上的油脂,用热碱液洗涤 |
| A. | NaCl | B. | CC14 | C. | Cu | D. | SO2 |
 的元素,位于元素周期表的( )
的元素,位于元素周期表的( )| A. | 第六周期第IV族 | B. | 第四周期第VI族 | C. | 第六周期第A族 | D. | 第四周期第VIA族 |
| A. | 过量的NaHSO4与Ba(OH)2溶液的反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| C. | 酸性条件下KIO3和KI溶液反应生成I2:IO3-+5I-+3H2O═3I2+6 OH- | |
| D. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
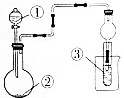 利用如图所示装置进行下列实验,不能得出相应实验结论的是( )
利用如图所示装置进行下列实验,不能得出相应实验结论的是( )| 选项 | ① | ② | ③ | ③中的现象 |
| A | 浓盐酸 | Na2SO3 | BaCl2溶液 | 出现浑浊 |
| B | 稀盐酸 | 石灰石 | 饱和Na2CO3溶液 | 出现浑浊 |
| C | 浓氨水 | 生石灰 | 酚酞溶液 | 出现红色 |
| D | 醋酸 | 贝壳 | 澄清石灰水 | 先浑浊后澄清 |
| A. | A | B. | B | C. | C | D. | D |
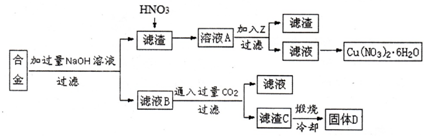
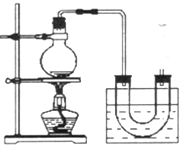 实验室制备溴乙烷(C2H5Br)的装置和步骤如图:
实验室制备溴乙烷(C2H5Br)的装置和步骤如图: