题目内容
(1)①pH=4的CH3COOH溶液稀释100倍后所得溶液pH②0.01mol/LCH3COOH溶液的pH
③0.1mol/LCH3COONa溶液的pH
(2)观察以上三个小题,证明某酸(HA)是弱电解质的原理可以有两个:一是证明HA不能完全电离,溶液中存在
(3)请你根据以上原理提出两种方案,证明CH3COOH是弱电解质,简要写出实验方案:
①
②
②CH3COOH是弱酸,在水溶液中部分电离;
③CH3COONa属于强碱弱酸盐,弱酸根离子在水溶液中水解显碱性;
(2)在水溶液里和熔融状态下部分电离的电解质是弱电解质,弱电解质中存在电离平衡;
(3)证明某酸(HA)是弱电解质的两种方案是测定酸的pH或其盐溶液的pH.
故答案为:<;
②CH3COOH是弱酸,在水溶液中部分电离,所以溶液中氢离子浓度小于酸的浓度,所以0.01mol/L CH3COOH溶液的pH>2,
故答案为:>;
③CH3COONa属于强碱弱酸盐,醋酸根离子在水溶液中水解CH3COO-+H2O?CH3COOH+OH-,显碱性,所以溶液的pH>7,
故答案为:>;
(2)弱电解质在水溶液里存在电离平衡,证明某酸(HA)属于弱电解质,可证明溶液中存在电离平衡,或证明HA与强碱生成盐的溶液具有碱性,
故答案为:电离;
(3)证明某酸(HA)是弱电解质的两种方案是测定酸的PH或其盐溶液的pH,因为pH容易测定,
故答案为:测量0.01mol/LHA溶液的pH,若大于2则为弱电解质;测量0.1mol/L CH3COONa溶液的pH,若大于7则为弱电解质;

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案(10分)有A、B、C、D四种强电解质,它们在水中电离可产生表中离子(每种物质只含一种阴离子且互不重复)。
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CO32-、Cl-、OH-、SO42- |
已知:
①A、C溶液的pH均大于7,A、B的溶液中水的电离程度比纯水大,A、D焰色反应的火焰均为黄色;
②C溶液和D溶液相遇时只观察到有白色沉淀产生,B溶液和C溶液相遇时只观察到有刺激性气味的气体产生,A溶液和D溶液混合时无明显现象。
请填写下列空白:
(1)A是___________,B是___________,C是____________,D是___________。
(2)常温,将1 mL pH =12的C溶液加水稀释至100mL,所得溶液中![]() = 。
= 。
(3)常温下,0.15 mol·L-1的C溶液与0.20 mol·L-1盐酸混合,所得混合液的pH=13,则C溶液与盐酸的体积比= _______________。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是 。
(10分)有A、B、C、D四种强电解质,它们在水中电离可产生表中离子(每种物质只含一种阴离子且互不重复)。
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CO32-、Cl-、OH-、SO42- |
①A、C溶液的pH均大于7,A、B的溶液中水的电离程度比纯水大,A、D焰色反应的火焰均为黄色;
②C溶液和D溶液相遇时只观察到有白色沉淀产生,B溶液和C溶液相遇时只观察到有刺激性气味的气体产生,A溶液和D溶液混合时无明显现象。
请填写下列空白:
(1)A是___________,B是___________,C是____________,D是___________。
(2)常温,将1 mL pH =12的C溶液加水稀释至100mL,所得溶液中
 = 。
= 。(3)常温下,0.15 mol·L-1的C溶液与0.20 mol·L-1盐酸混合,所得混合液的pH=13,则C溶液与盐酸的体积比= _______________。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是 。
有A、B、C、D四种强电解质,它们在水中电离可产生表中离子(每种物质只含一种阴离子且互不重复)。
|
阳离子 |
Na+、Ba2+、NH4+ |
阴离子 |
CO32-、Cl-、OH-、SO42- |
①A、C溶液的pH均大于7,A、B的溶液中水的电离程度比纯水大,A、D焰色反应的火焰均为黄色;
②C溶液和D溶液相遇时只观察到有白色沉淀产生,B溶液和C溶液相遇时只观察到有刺激性气味的气体产生,A溶液和D溶液混合时无明显现象。请填写下列空白:
(1)A是___________,B是___________,C是____________,D是___________。
(2)常温,将1 ml pH =12的C溶液加水稀释至100ml,所得溶液中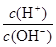 =
;
=
;
(3)常温下,0.15 mol·L-1的C溶液与0.20 mol·L-1盐酸混合,所得混合液的pH=13,则C溶液与盐酸的体积比= _______________。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是 。
(10分)有A、B、C、D四种强电解质,它们在水中电离可产生表中离子(每种物质只含一种阴离子且互不重复)。
|
阳离子 |
Na+、Ba2+、NH4+ |
|
阴离子 |
CO32-、Cl-、OH-、SO42- |
已知:
①A、C溶液的pH均大于7,A、B的溶液中水的电离程度比纯水大,A、D焰色反应的火焰均为黄色;
②C溶液和D溶液相遇时只观察到有白色沉淀产生,B溶液和C溶液相遇时只观察到有刺激性气味的气体产生,A溶液和D溶液混合时无明显现象。
请填写下列空白:
(1)A是___________,B是___________,C是____________,D是___________。
(2)常温,将1 mL pH =12的C溶液加水稀释至100mL,所得溶液中 = 。
= 。
(3)常温下,0.15 mol·L-1的C溶液与0.20 mol·L-1盐酸混合,所得混合液的pH=13,则C溶液与盐酸的体积比= _______________。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是 。
有A、B、C、D四种强电解质,它们在水中电离可产生表中离子(每种物质只含一种阴离子且互不重复)。
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CO32-、Cl-、OH-、SO42-[来 |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度比纯水大,A、D焰色反应的火焰均为黄色;②C溶液和D溶液相遇时只观察到有白色沉淀产生,B溶液和C溶液相遇时只观察到有刺激性气味的气体产生,A溶液和D溶液混合时无明显现象。
请填写下列空白:
(1)A是___________,B是___________,C是____________,D是___________。
(2)常温,将1 mL pH =12的C溶液加水稀释至100mL,所得溶液中![]() = 。
= 。
(3)常温下,0.15 mol·L-1的C溶液与0.20 mol·L-1盐酸混合,所得混合液的pH=13,则C 溶液与盐酸的体积比= _______________。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是 。