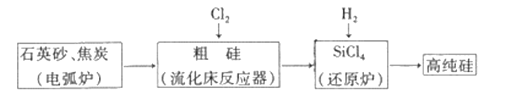
题目内容
【题目】I、铁是生产、生活及生命中的重要元素。
(1)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合能力。药品美蓝是其有效的解毒剂,解毒时美蓝发生_____反应(填“氧化”或“还原”)。
(2)普通铁粉与水蒸气在高温下反应生成铁的某种氧化物和氢气,该氧化物和氢气在高温下发生逆反应得到“引火铁”。 “引火铁”是一种极细的铁粉,它在空气中可以自燃,其原因是_____________。
Ⅱ、在1 L 2 mol·L-1稀硝酸溶液中逐渐加入铁粉,反应中氧化产物的物质的量与加入铁粉的物质的量的关系如图所示:
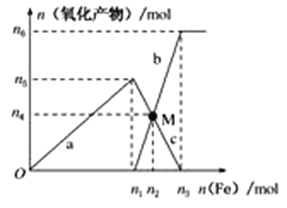
回答下列问题:
(1)写出加入n1mol铁所发生反应的离子方程式_______________________________。
(2)整个过程中转移电子的数目是________。
(3)若M点时再加入V L 2 mol·L-1的稀硝酸,恰好反应完全,则V为___________。
(4)研究表明硝酸的浓度越小,反应后氮的化合价越低。在极稀的硝酸溶液中加入少量铁粉,生成NH4+的离子方程式为___________________________________________________。
【答案】氧化 铁粉表面积大反应速率快 Fe+4H++NO3-=2H2O+NO↑+Fe3+ 2NA 0.2 8Fe+30H++3NO3-=3NH4++8Fe3++9H2O
【解析】
I(1)根据美蓝能将高铁血红蛋白还原为低铁血红蛋白使其恢复与氧结合的能力进行分析;
(2)根据固体接触面积与化学反应速率的关系分析;
Ⅱ 向稀硝酸中加入铁粉时,发生两个过程,开始先生成Fe(NO3)3,反应方程式为:Fe+4 HNO3(稀)=Fe(NO3)3+NO↑+2H2O,当铁过量时,过量的铁与Fe(NO3)3 继续反应生成 Fe(NO3)2,反应方程式为:2Fe(NO3)3+Fe=3 Fe(NO3)2,由此分析解答.
(1)美蓝能将高铁血红蛋白还原为低铁血红蛋白使其恢复与氧结合的能力,因此解毒时美蓝发生氧化反应;
答案:氧化
(2)铁粉与水蒸气反应,接触面积越大,反应速率越快;
答案:铁粉表面积大反应速率快
Ⅱ(1)因为硝酸足量,因此0~n1mol,铁与稀硝酸反应,生成硝酸铁,一氧化氮和水,离子方程式为Fe+4H++NO3-=2H2O+NO↑+Fe3+;
答案:Fe+4H++NO3-=2H2O+NO↑+Fe3+
(2)整个过程中铁最终被氧化为硝酸亚铁,其中硝酸的物质的量为2mol/L×1L=2mol;
Fe+4 HNO3(稀)=Fe(NO3)3+NO↑+2H2O 转移电子数
4mol 1mol 3NA
2mol 0.5mol 1.5NA
2Fe(NO3)3+Fe=3 Fe(NO3)2 转移电子数
2mol 2NA
0.5mol0.5NA
转移电子数为1.5NA+0.5NA=2NA
答案:2NA
(3)M点时铁离子和亚铁离子物质的量相等,再加入V L 2 mol·L-1的稀硝酸,恰好反应完全,亚铁离子被氧化为铁离子;
Fe + 4 HNO3(稀)=Fe(NO3)3+NO↑+2H2O
1mol 4mol 1mol
2mol 0.5mol
2Fe(NO3)3+Fe= 3 Fe(NO3)2
2mol 3mol
![]() n(Fe2+)
n(Fe2+)
根据M点时铁离子和亚铁离子物质的量相等可知0.5-![]() =n(Fe2+),得n(Fe2+)=0.3mol
=n(Fe2+),得n(Fe2+)=0.3mol
3Fe(NO3)2+4HNO3=3Fe(NO3)3+NO↑+2H2O
3mol 4mol
0.3mol 2V
![]() =
=![]() ,得V=0.2L;
,得V=0.2L;
答案:0.2
(4)极稀的硝酸溶液中加入少量铁粉,硝酸被还原为铵盐,铁粉少量被氧化为硝酸铁,离子方程式为8Fe+30H++3NO3-=3NH4++8Fe3++9H2O;
答案:8Fe+30H++3NO3-=3NH4++8Fe3++9H2O

【题目】元素①~⑩在周期表中的位置如下表所示:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
回答下列问题:
(1)最外层电子数为2的元素有________(填元素符号);⑨的简单离子结构示意图为________,①与⑥以原子个数比为1:1形成的化合物的电子式为________,用电子式表示⑦与⑩形成化合物的过程________________________。
(
(3)高温灼烧⑦与⑩两种元素形成的化合物时,火焰呈________色。⑧可用于航空航天合金材料的制备,工业上冶炼该单质的化学方程式为________。
(4)④、⑤、⑥的气态氢化物中最稳定的是________。