题目内容
在500ml的密闭容器中装入1.5mol H2、0.5mol N2和0.05mol NH3.已知
H2=0.3mol?L-1?min-1,求3分钟末时H2、N2、NH3的物质的量浓度.
. |
| v |
考点:化学平衡的计算
专题:化学平衡专题
分析:氢气的反应速率v(H2)=0.3mol?L-1?min-1,依据反应速率之比等于化学方程式计量数之比计算氮气、氨气的反应速率,计算反应中物质变化的物质的量得到3min末物质物质的量,结合浓度概念计算c=
得到;
| n |
| V |
解答:
解:N2+3H2=2NH3,反应速率之比等于化学方程式计量数之比,v(N2)=
v(H2)=
×0.3mol?L-1?min-1=0.1mol?L-1?min-1,反应的氮气物质的量为n(N2)=0.1mol?L-1?min-1×3min×0.5L=0.15mol,则3min末氮气的浓度=
=0.7mol/L;
氢气消耗物质的量=0.3mol?L-1?min-1×0.5L×3min=0.45mol,剩余氢气物质的量=1.5mol-0.45mol=1.05mol,c(H2)=
=2.1mol/L;
v(NH3)=
v(H2)=
×0.3mol?L-1?min-1=0.2mol/L?min,反应生成氨气的物质的量=0.2mol?L-1min-1×0.5L×3min=0.3mol,3min末的氨气物质的量=0.3mol+0.05mol=0.35mol,则c(NH3)=
=0.7mol/L;
答:3分钟末时H2、N2、NH3的物质的量浓度分别为:2.1mol/L;0.7mol/L;0.7mol/L;
| 1 |
| 3 |
| 1 |
| 3 |
| 0.5mol-0.15mol |
| 0.5L |
氢气消耗物质的量=0.3mol?L-1?min-1×0.5L×3min=0.45mol,剩余氢气物质的量=1.5mol-0.45mol=1.05mol,c(H2)=
| 1.05mol |
| 0.5L |
v(NH3)=
| 2 |
| 3 |
| 2 |
| 3 |
| 0.35mol |
| 0.5L |
答:3分钟末时H2、N2、NH3的物质的量浓度分别为:2.1mol/L;0.7mol/L;0.7mol/L;
点评:本题考查了化学平衡计算,反应速率概念的计算应用,掌握基础是关键,题目较简单.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案
相关题目
2005年6月5日是第34个世界环境日,联合国环境署确定今年的活动主题是“营造绿色城市,呵护地球家园”,我国环保总局确定的主题是“人人参与,创建绿色家园”,下列活动不符合这一主题的是( )
| A、推广垃圾分类存放,分类回收,分类处理 |
| B、将工厂的烟囱造高,以减少工厂周围的大气污染 |
| C、推广使用液化石油气(LPG)替代汽油和柴油作公交车和出租车的燃料 |
| D、改革传统采煤时将煤层气(瓦斯气,主要成分甲烷)直接排入空气的做法,先开采和综合利用煤层气,然后再采煤 |
 此烃名称为
此烃名称为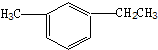 的烃可命名为
的烃可命名为 的烃可命名为:
的烃可命名为:
 表示的分子式
表示的分子式 在一定条件下进行下列可逆反应的实验:A(g)+2B(g)?3C(g);△H>0
在一定条件下进行下列可逆反应的实验:A(g)+2B(g)?3C(g);△H>0 