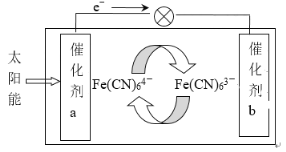
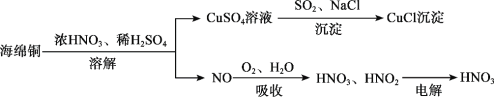
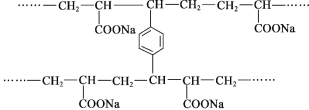
题目内容
【题目】把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中,有0.58g白色沉淀析出,向所得的浊液中,逐滴加入0.5mol/L 的盐酸,加入盐酸的体积和生成沉淀的质量如图所示:
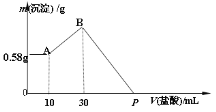
(1)混合物中NaOH的质量是_______g
(2)AlCl3的物质的量是____________ mol
(3)MgCl2的物质的量是___________ mol
(4)P点所表示盐酸加入体积为___________ mL
【答案】2.6g 0.01mol 0.01mol 130mL
【解析】
根据图像得出0.58g沉淀是氢氧化镁沉淀,物质的量为0.01mol,加盐酸,先无现象,说明氢氧化钠过量,再继续加盐酸,产生了氢氧化铝沉淀,再加盐酸,沉淀溶解。
(1)在P点,溶质为氯化钠、氯化镁、氯化铝的混合物,实际是盐酸和氢氧化钠反应生成氯化钠,因此n(NaOH)=n(HCl)=cV=0.5mol/L×0.13L=0.065mol,其NaOH质量![]() ;
;
(2)根据AB得出偏铝酸根变为氢氧化铝,铝守恒,消耗盐酸物质的量为n=cV=0.5mol/L×0.02L=0.01 mol,因此AlCl3的物质的量是0.01mol;
(3)氢氧化镁0.58g,物质的量为![]() ,根据镁守恒,MgCl2的物质的量是0.01mol;
,根据镁守恒,MgCl2的物质的量是0.01mol;
(4)B点沉淀是0.01mol氢氧化镁和0.01mol氢氧化铝,则BP是沉淀溶解的阶段,按照方程式关系,0.01mol氢氧化镁被0.02mol盐酸溶解,0.01mol氢氧化铝被0.03mol盐酸溶解,总共消耗盐酸0.05mol,需要加入盐酸体积![]() ,即100mL,P点所表示盐酸加入体积为(100+30)=130 mL。
,即100mL,P点所表示盐酸加入体积为(100+30)=130 mL。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目