题目内容
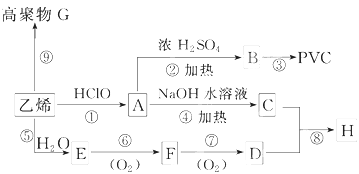
 硫酸工业中废渣的成分为SiO2、Fe2O3、Al2O3、MgO.某探究性学习小组的同学设计以下实验方案,将硫酸渣中金属元素转化为氢氧化物沉淀分离开来.
硫酸工业中废渣的成分为SiO2、Fe2O3、Al2O3、MgO.某探究性学习小组的同学设计以下实验方案,将硫酸渣中金属元素转化为氢氧化物沉淀分离开来.已知常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀时的pH | 1.9 | 3.7 | 9.6 |
| 沉淀完全时的pH | 3.2 | 5.2 | 11.0 |
(2)实验室用11. 9mol/L的浓盐酸配制250ml3.0mol/L的稀盐酸,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要
(3)上述流程中的试剂Y最好选用下列中的
A.水 B.氧化镁 C.氨水 D.氢氧化钠
(4)写出溶液D中的金属离子在加入试剂Y时发生反应的离子方程式
(5)实验室可用大理石和稀盐酸反应制取上述流程中所需的CO2,仪器如下,装置A产生CO2,按气流方向连接各仪器接口,顺序为a→
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:先判断各物质的组成,在根据题目要求分析该题.
硫酸渣的成分为SiO2、Fe2O3、Al2O3、MgO,当向硫酸渣中加过量盐酸时,二氧化硅和盐酸不反应,所以固体A是二氧化硅,氧化铁、氧化铝、氧化镁和盐酸反应,所以溶液B的溶质是氯化镁、氯化铁、氯化铝、盐酸;向溶液B中加试剂X并调节溶液的PH值为3.5,结合题意溶液pH=3.5时Fe3+已经沉淀完全知,试剂X是能和氯化铁反应生成沉淀的物质且和铝离子反应没有沉淀生成,所以试剂X只能是强碱溶液,固体C是氢氧化铁;向溶液D中加入试剂Y并调节溶液的PH值为13,溶液呈强碱性溶液,铝元素在溶液中以偏铝酸根离子存在,镁离子和氢氧根离子生成氢氧化镁沉淀,所以固体E是氢氧化镁;溶液F的溶质含有偏铝酸钠和氯化钠,向F溶液中通入过量二氧化碳气体,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀,所以G是氢氧化铝.
(1)根据二氧化硅和氢氧化钠的性质写出相应的化学反应方程式.
(2)根据配制一定物质的量浓度溶液的步骤选择所需仪器;
(3)依据阳离子Mg2+以氢氧化物形式沉淀所需试剂的选择,根据题给信息和流程可知应该先用氢氧化钠液将Mg2+转化成氢氧化镁沉淀析出同时将Al3+转化成AlO2-;
(4)向溶液D中加入氢氧化钠并调节溶液的PH值为13,溶液呈强碱性溶液,铝元素在溶液中以偏铝酸根离子存在,镁离子和氢氧根离子生成氢氧化镁沉淀;
(5)依据CO2气体的实验室制备、除杂、收集方法.学生需根据实验室制备CO2的原理将所给仪器进行合理地组装.利用大理石和稀盐酸本来反应得到的CO2气体中会混有HCl气体气质,应通过盛有饱和NaHCO3溶液的洗气瓶来除去;CO2气体密度大于空气,应采用向上排空气法集.
硫酸渣的成分为SiO2、Fe2O3、Al2O3、MgO,当向硫酸渣中加过量盐酸时,二氧化硅和盐酸不反应,所以固体A是二氧化硅,氧化铁、氧化铝、氧化镁和盐酸反应,所以溶液B的溶质是氯化镁、氯化铁、氯化铝、盐酸;向溶液B中加试剂X并调节溶液的PH值为3.5,结合题意溶液pH=3.5时Fe3+已经沉淀完全知,试剂X是能和氯化铁反应生成沉淀的物质且和铝离子反应没有沉淀生成,所以试剂X只能是强碱溶液,固体C是氢氧化铁;向溶液D中加入试剂Y并调节溶液的PH值为13,溶液呈强碱性溶液,铝元素在溶液中以偏铝酸根离子存在,镁离子和氢氧根离子生成氢氧化镁沉淀,所以固体E是氢氧化镁;溶液F的溶质含有偏铝酸钠和氯化钠,向F溶液中通入过量二氧化碳气体,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀,所以G是氢氧化铝.
(1)根据二氧化硅和氢氧化钠的性质写出相应的化学反应方程式.
(2)根据配制一定物质的量浓度溶液的步骤选择所需仪器;
(3)依据阳离子Mg2+以氢氧化物形式沉淀所需试剂的选择,根据题给信息和流程可知应该先用氢氧化钠液将Mg2+转化成氢氧化镁沉淀析出同时将Al3+转化成AlO2-;
(4)向溶液D中加入氢氧化钠并调节溶液的PH值为13,溶液呈强碱性溶液,铝元素在溶液中以偏铝酸根离子存在,镁离子和氢氧根离子生成氢氧化镁沉淀;
(5)依据CO2气体的实验室制备、除杂、收集方法.学生需根据实验室制备CO2的原理将所给仪器进行合理地组装.利用大理石和稀盐酸本来反应得到的CO2气体中会混有HCl气体气质,应通过盛有饱和NaHCO3溶液的洗气瓶来除去;CO2气体密度大于空气,应采用向上排空气法集.
解答:
解:硫酸渣的成分为SiO2、Fe2O3、Al2O3、MgO,当向硫酸渣中加过量盐酸时,二氧化硅和盐酸不反应,所以固体A是二氧化硅,氧化铁、氧化铝、氧化镁和盐酸反应,所以溶液B的溶质是氯化镁、氯化铁、氯化铝、盐酸;向溶液B中加试剂X并调节溶液的PH值为3.5,结合题意溶液pH=3.5时Fe3+已经沉淀完全知,试剂X是能和氯化铁反应生成沉淀的物质且和铝离子反应没有沉淀生成,所以试剂X只能是强碱溶液,固体C是氢氧化铁;向溶液D中加入试剂Y并调节溶液的PH值为13,溶液呈强碱性溶液,铝元素在溶液中以偏铝酸根离子存在,镁离子和氢氧根离子生成氢氧化镁沉淀,所以固体E是氢氧化镁;溶液F的溶质含有偏铝酸钠和氯化钠,向F溶液中通入过量二氧化碳气体,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀,所以G是氢氧化铝.
(1)通过以上分析知,A是二氧化硅,二氧化硅是酸性氧化物,能和强碱反应生成盐和水,
所以反应方程式为:SiO2+2NaOH=Na2SiO3+H2O.
故答案为:SiO2+2NaOH=Na2SiO3+H2O.
(2)实验室用11.9mol/L的浓盐酸配制250mL3.0mol/L的稀盐酸,要求掌握一定物质的量浓度溶液的配制实验.所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要250mL容量瓶和胶头滴管;
故答案为:250mL容量瓶、胶头滴管;
(3)阳离子Mg2+以氢氧化物形式沉淀所需试剂,根据题给信息和流程可知应该先用氢氧化钠溶液将Mg2+转化成氢氧化镁沉淀析出同时将Al3+转化成AlO2-溶液;
故答案为:D;
(4)向溶液D中加入氢氧化钠并调节溶液的PH值为13,溶液呈强碱性溶液,铝元素在溶液中以偏铝酸根离子存在,镁离子和氢氧根离子生成氢氧化镁沉淀,
反应的离子方程式为:Al3++4OH-=AlO2-+2H2O,Mg2++2OH-=Mg(OH)2↓;
故答案为:Al3++4OH-=AlO2-+2H2O,Mg2++2OH-=Mg(OH)2↓;
(5)利用大理石和稀盐酸反应得到的CO2气体中会混有HCl气体气质,应通过盛有饱和NaHCO3溶液的洗气瓶来除去;CO2气体密度大于空气,应采用向上排空气法集,实验室可用大理石和稀盐酸反应制取上述流程中所需的CO2,仪器如下,装置A产生CO2,按气流方向连接各仪器接口,顺序为a→d→e→c→b;
故答案为:d→e→c→b;饱和NaHCO3溶液.
(1)通过以上分析知,A是二氧化硅,二氧化硅是酸性氧化物,能和强碱反应生成盐和水,
所以反应方程式为:SiO2+2NaOH=Na2SiO3+H2O.
故答案为:SiO2+2NaOH=Na2SiO3+H2O.
(2)实验室用11.9mol/L的浓盐酸配制250mL3.0mol/L的稀盐酸,要求掌握一定物质的量浓度溶液的配制实验.所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要250mL容量瓶和胶头滴管;
故答案为:250mL容量瓶、胶头滴管;
(3)阳离子Mg2+以氢氧化物形式沉淀所需试剂,根据题给信息和流程可知应该先用氢氧化钠溶液将Mg2+转化成氢氧化镁沉淀析出同时将Al3+转化成AlO2-溶液;
故答案为:D;
(4)向溶液D中加入氢氧化钠并调节溶液的PH值为13,溶液呈强碱性溶液,铝元素在溶液中以偏铝酸根离子存在,镁离子和氢氧根离子生成氢氧化镁沉淀,
反应的离子方程式为:Al3++4OH-=AlO2-+2H2O,Mg2++2OH-=Mg(OH)2↓;
故答案为:Al3++4OH-=AlO2-+2H2O,Mg2++2OH-=Mg(OH)2↓;
(5)利用大理石和稀盐酸反应得到的CO2气体中会混有HCl气体气质,应通过盛有饱和NaHCO3溶液的洗气瓶来除去;CO2气体密度大于空气,应采用向上排空气法集,实验室可用大理石和稀盐酸反应制取上述流程中所需的CO2,仪器如下,装置A产生CO2,按气流方向连接各仪器接口,顺序为a→d→e→c→b;
故答案为:d→e→c→b;饱和NaHCO3溶液.
点评:本题考查了物质的分离与提纯、溶液配制实验过程和仪器选择,掌握物质性质和实验流程分析是解题关键,题目难度中等.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
现有NaOH、Na2CO3、Ba(OH)2三种无色溶液,下列哪种试剂能将这三种物质鉴别( )
| A、NH4Cl |
| B、H2SO4 |
| C、AgNO3 |
| D、CuCl2 |
下列物质不属于电解质的是( )
| A、Cu |
| B、KOH |
| C、H2SO4 |
| D、Na2CO3 |