题目内容
2.下列关于金属元素特征的叙述,正确的是( )| A. | 金属元素的原子只有还原性,离子只有氧化性 | |
| B. | 金属元素在化合物中一定显正价 | |
| C. | 金属单质都可以和酸反应置换出氢气 | |
| D. | 金属元素的单质在常温下均为固体 |
分析 A.二价铁离子既具有氧化性又具有还原性;
B.金属元素在反应中只能失去电子;
C.金属单质与氧化性酸反应得不到氢气;
D.汞在常温下为液体.
解答 解:A.二价铁离子既具有氧化性又具有还原性,故A错误;
B.金属元素在反应中失去电子,则化合价一定升高,所以金属元素在化合物中一定显正价,故B正确;
C.金属单质与氧化性酸反应得不到氢气,如铁与稀硝酸反应生成气体为一氧化氮,故C错误;
D.多数金属元素的单质在常温下均为固体,汞在常温下为液体,故D错误;
故选:B.
点评 本题考查了金属的通性,熟悉常见的金属单质及金属对应的阳离子是解答本题的关键,难度不大.

练习册系列答案
相关题目
12.氰(CN)2,硫氰(SCN)2等称为拟卤素,与卤素单质性质相似,它们的阴离子与也卤素阴离子性质相似,阴离子的还原性顺序为:Cl-<Br-<CN-<SCN-<I-,又知,拟卤素形成的无氧酸和含氧酸一般为弱酸,下列反应中,不合理的是( )
| A. | 4HCN(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn(CN)2+(CN)2↑+2H2O | |
| B. | (CN)2+H2O═2H++CN-+CNO- | |
| C. | (CN)2+2OH-═CN-+CNO-+H2O | |
| D. | (CN)2+2SCN-═2CN-+(SCN)2 |
10.国庆庆典中的焰火晚会上绚丽的焰火给世人留下了深刻印象,美丽的焰火与高中化学中“焰色反应”知识相关.下列说法中正确的是( )
| A. | 焰色反应反映出物质的化学性质 | |
| B. | 所有金属及其化合物灼烧时火焰均有颜色 | |
| C. | 焰色反应均应透过蓝色钴玻璃观察 | |
| D. | NaCl与Na2CO3灼烧时火焰颜色相同 |
7.已知${\;}_{17}^{35}$Cl的相对原子质量为34.969,下列相关说法正确的是( )
| A. | 氯元素的近似相对原子质量为35 | B. | 氯元素的某种同位素的质量数为35 | ||
| C. | 氯元素的中子数为18 | D. | 氯原子的质量为34.969 |
14.锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性.锂离子电池放电时的电极反应式为
负极反应:C6Li-xe-═C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成的复合材料)
正极反应:Li1-xMO2+xLi++x e-═LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列有关说法正确的是( )
负极反应:C6Li-xe-═C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成的复合材料)
正极反应:Li1-xMO2+xLi++x e-═LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列有关说法正确的是( )
| A. | 锂离子电池放电时电池反应为LiMO2+C6Li1-x═C6Li+Li1-xMO2 | |
| B. | 锂离子电池充电时电池内部Li+向负极移动 | |
| C. | 锂离子电池放电时电池内部电流从负极流向正极 | |
| D. | 锂离子电池充电时阳极反应为C6Li1-x+xLi++xe-═C6Li |
12.下列实验方案中,不能测定Na2C03和NaHCO3混合物中Na2CO3质量分数的是( )
| A. | 取a克混合物充分加热,得b1克固体 | |
| B. | 取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b2克固体 | |
| C. | 取a克混合物与足量浓盐酸充分反应,逸出气体用碱石灰吸收,增重b3克 | |
| D. | 取a克混合物与足量Ba(0H)2溶液充分反应,过滤、洗涤、烘干,得b4克固体 |
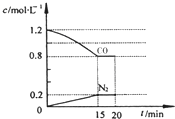 回答下列问题:
回答下列问题: 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.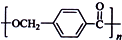 的路线:
的路线: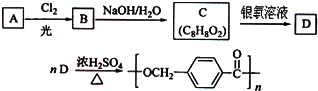
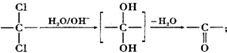
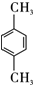 .
. ,该反应过程中生成的不稳定中间体的结构简式应是
,该反应过程中生成的不稳定中间体的结构简式应是 .
.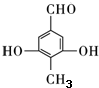 .
.