题目内容
下列叙述正确的是
| A.同周期元素的原子半径以VIIA族的为最大 |
| B.同主族元素两种元素原子的核外电子数的差值可能为26 |
| C.短周期元素中次外层电子数是最外层电子数2倍的原子一定是非金属元素 |
| D.科学家在周期表中金属与非金属的分界线处找到了优良的催化剂 |
B
解析试题分析:A、同周期元素的原子半径以IA族的为最大,错误;B、同主族元素两种元素原子的核外电子数的差值可能为26,第一、二主族的元素与其相隔一个周期的同族元素之间满足核外电子数的差值可能为26,正确;C、短周期元素中次外层电子数是最外层电子数2倍的原子不一定是非金属元素,如Li为金属元素,错误;D、科学家在周期表中金属与非金属的分界线处找到了优良的半导体材料,错误,答案选B。
考点:考查对元素周期表的理解应用

 名校课堂系列答案
名校课堂系列答案卤素单质可以参与很多化学反应, 如:NF3可由NH3和F2在Cu催化剂存在下反应直接得到;反应①: 2NH3+3F2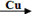 NF3+ 3NH4F
NF3+ 3NH4F
利用“化学蒸气转移法”制备TaS2晶体; 反应②:TaI4(g)+S2(g)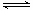 TaS2(s)+2I2(g)+Q kJ,Q>0
TaS2(s)+2I2(g)+Q kJ,Q>0
(1)反应①中:非金属性最强的元素原子核外有_________种不同运动状态的电子;该反应中的某元素的单质可作粮食保护气,则该元素最外层的电子有____________种自旋方向。
(2)反应①中:物质所属的晶体类型有________________________________;
并写出所有原子符合8电子稳定结构的化合物的电子式_______________________。
(3)反应②中:平衡常数表达式K=_____________________,若反应达到平衡后,保持其他条件不变,降低温度,重新达到平衡时 ______________。
| A.平衡常数K增大 | B.S2的浓度减小 | C.I2的质量减小 | D.V(TaI4)逆 增大 |
(5)某同学对反应②又进行研究,他查阅资料,发现硫单质有多种同素异形体,可表示Sx,且在一定条件下可以相互转化,他认为仅增大压强对平衡是有影响的,则TaI4的平衡转化率会____________(填增大或减小),其原因是________________________ 。
用下表提供的仪器和药品,能达到实验目的的是
| 编号 | 仪器 | 药品 | 实验目的 |
| A | 烧杯、分液漏斗、胶头滴管、铁架台 | 待提纯的AlCl3溶液、NaOH溶液 | 提纯混有MgCl2杂质的AlCl3溶液 |
| B | 分液漏斗、烧瓶、锥形瓶、导管及橡皮塞 | 盐酸、大理石、 碳酸钠溶液 | 证明非金属性:Cl>C>Si |
| C | 酸式滴定管、胶头滴管、铁架台(带铁夹) | 已知浓度的盐酸、 待测NaOH溶液 | 测定NaOH溶液的物质的量浓度 |
| D | 酒精灯、玻璃棒、 蒸发皿、铁架台(带铁圈) | NaCl溶液 | 蒸发溶液得到晶体 |
(双选)关于碱金属单质的性质叙述错误的是( )。
| A.在空气中燃烧的生成物都是过氧化物 |
| B.与水反应都能生成碱和氢气 |
| C.熔、沸点随原子序数增加而升高 |
| D.还原性随原子电子层数的增加而增强 |
俄罗斯科学家宣布在实验中获得了 和
和 两种新原子。下列有关
两种新原子。下列有关 和
和 的说法错误的是( )
的说法错误的是( )
| A.质量数均超过质子数的两倍 |
| B.互称为同位素 |
| C.中子数分别为176、177 |
| D.是同一种核素 |
简单原子的原子结构可用下图形象地表示。其中●表示质子或电子,○表示中子,则下列有关①②③的叙述正确的组合是 ( )
a.①②③互为同位素
b.①②③互为同素异形体
c.①②③是三种化学性质不同的粒子
d.①②③具有相同的质量数
e.①②③具有相同的质量
f.①②③是三种不同的原子
| A.a、f | B.b、c | C.d、e | D.e、f |
在短周期元素中,若某元素原子的最外层电子数与其电子层数相等,则符合条件的元素种数为( )。
| A.1种 | B.2种 | C.3种 | D.4种 |
短周期元素甲、乙、丙、丁、戊五种元素在元素周期表中的位置如右图所示,其中戊是同周期中原子半径最小的元素。下列有关判断正确的是( )
| A.最外层电子数:甲>乙>丙>丁>戊 |
| B.简单离子的离子半径:戊>丁 |
| C.含有丁元素的酸有多种 |
| D.乙的氢化物多种多样,丙、丁、戊的氢化物各有一种 |
下列有关电负性的说法中正确的是( )。
| A.主族元素的电负性越大,元素原子的第一电离能一定越大 |
| B.在元素周期表中,元素电负性从左到右越来越大 |
| C.金属元素的电负性一定小于非金属元素的电负性 |
| D.在形成化合物时,电负性越小的元素越容易显正价 |