题目内容
某实验小组为研究氧化还原反应,设计了如下一系列实验:在碘水中加入淀粉溶液,溶液变蓝色.再加入镁粉,充分振荡,蓝色消失.请用化学方程式解释上述现象: ,该反应中氧化剂是: .
考点:氧化还原反应
专题:
分析:加入镁粉,与碘水中的HI反应,使I2+H2O?HI+HIO正向移动,溶液褪色,以此来解答.
解答:
解:溶液中存在I2+H2O?HI+HIO,加入Mg后发生Mg+2HI=MgI2+H2↑使上述平衡正向移动,则溶液褪色,Mg+2HI=MgI2+H2↑中H元素的化合价降低,HI为氧化剂,
故答案为:Mg+2HI=MgI2+H2↑;HI.
故答案为:Mg+2HI=MgI2+H2↑;HI.
点评:本题考查氧化还原反应,为高频考点,把握Mg与酸的反应及平衡移动原理的应用为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
可逆反应3A(g)3B+C;△H>0,随着温度升高,气体的平均相对分子质量有变小的变化趋势.下列关于B、C两种物质的聚集状态的判断错误的是( )
| A、B和C可能都是固体 |
| B、B和C可能都是气体 |
| C、B和C一定都是气体 |
| D、若C为固体,则B一定是气体 |
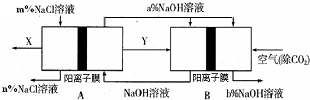 氯碱工业是一种高耗能产业,一种将燃料电池与电解池组合的新工艺可节能30%以上,如图是该工艺图示(电极未标出).下列说法正确的是( )
氯碱工业是一种高耗能产业,一种将燃料电池与电解池组合的新工艺可节能30%以上,如图是该工艺图示(电极未标出).下列说法正确的是( )| A、X为H2,Y为Cl2 |
| B、A池为电解池,且m<n |
| C、B池为燃料电池,且a>b |
| D、该工艺优点是燃料电池提供电能且能提高烧碱产品的浓度 |
对于反应3Cl2+6NaOH
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
| ||
| A、Cl2是氧化剂,NaOH是还原剂 |
| B、氧化剂得电子数与还原剂失电子数之比为1:1 |
| C、NaCl是氧化产物 |
| D、被氧化的氯原子和被还原的氯原子的物质的量之比为1:1 |
下列物质分子的几何构型为三角锥形的是( )
| A、CO2 |
| B、P4 |
| C、NH3 |
| D、H2O |
同温同压下,等体积的两容器内分别充满NO和13CO气体,下列对两容器中气体的判断正确的是( )
| A、中子数相同 |
| B、分子数不同 |
| C、质子数相同 |
| D、气体质量相同 |
质量分数为a的某物质的溶液m g与质量分数为b的该物质的溶液n g混合后,蒸发掉p g水,得到的溶液密度为q g/cm3(此过程中无溶质析出),物质的量浓度为c mol?L-1.则溶质的相对分子质量为( )
A、
| ||
B、
| ||
C、
| ||
D、
|