题目内容
甲醇、氧气和强碱溶液做电解质的手机电池中的反应为:2CH3OH+3O2+4OH-
2CO32-+6H2O,有关说法正确的是( )
| 放电 |
| 充电 |
| A、放电时,CH3OH参与反应的电极为正极 |
| B、放电时,负极电极反应:CH3OH+8OH--6e-=CO32-+6H2O |
| C、通入11.2LO2完全反应有1mol电子转移 |
| D、充电时电解质溶液的pH逐渐减小 |
考点:原电池和电解池的工作原理
专题:
分析:根据2CH3OH+3O2+4OH-
2CO32-+6H2O知,甲醇失去电子发生氧化反应,所以负极上燃料发生电极反应;氧气得电子发生还原反应,所以正极为氧气得电子发生还原反应,1mol氧气反应转移4mol电子,根据电极反应式判断电极附近溶液的pH值变化.
| 放电 |
| 充电 |
解答:
解:A、正极上得电子发生还原反应,根据2CH3OH+3O2+4OH-
2CO32-+6H2O知,放电时,氧气参与反应的电极为正极,故A错误;
B、放电时,负极上甲醇失电子发生氧化反应,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,故B正确;
C、2CH3OH+3 O2+4OH-
2CO32-+6H2O 转移电子
67.2L 12mol
11.2L 2mol
所以,标况下,通入11.2LO2并完全反应后,有2mol电子转移,故C错误;
D、放电时,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为
O2+3H2O+6e-=6OH-,所以通入氧气的电极附近溶液的pH升高,故D错误;
故选B.
| 放电 |
| 充电 |
B、放电时,负极上甲醇失电子发生氧化反应,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,故B正确;
C、2CH3OH+3 O2+4OH-
| 放电 |
| 充电 |
67.2L 12mol
11.2L 2mol
所以,标况下,通入11.2LO2并完全反应后,有2mol电子转移,故C错误;
D、放电时,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为
| 3 |
| 2 |
故选B.
点评:本题以燃料电池为载体考查了原电池原理,根据电池反应式判断正负极上发生反应的物质及电极附近溶液PH值的变化即可解答本题,难度较大.

练习册系列答案
相关题目
在120℃,101Kpa下,下列各组烃不论以何种比例混合,在足量氧气中点燃,恢复到原状况体积没有变化的是( )
| A、CH4 C2H8 |
| B、C2H4 C2H2 |
| C、C2H2 C2H6 |
| D、CH4 C2H4 |
已知在粗碘中含ICl和IBr,受热时ICl、IBr均可升华;若在粗碘中加入一种物质再进行升华,则可制得精碘.在下列物质中,应加入的物质是( )
| A、H2O |
| B、Zn |
| C、KI |
| D、NaCl |
MCFC型燃料电池可同时供应电和水蒸气,其工作温度为600~700℃,所用燃料为H2,电解质为熔融的K2CO3.该电池的总反应式为:2H2+O2=2H2O,负极反应为:H2+CO32--2e-=H2O+CO2.则下列推断中,正确的是( )
| A、正极反应为4OH--4e-=2H2O+O2↑ |
| B、放电时CO32-向负极移动 |
| C、当生成1 mol水时,转移4 mol电子 |
| D、通H2的一极为负极,发生还原反应 |
某原电池装置如图所示,盐桥中装有用饱和氯化钾溶液浸泡过的琼脂.下列叙述正确的是( )
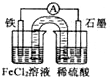

| A、原电池工作一段时间后,FeCl2溶液中c(Cl-)会增大 |
| B、此电池工作原理与硅太阳能电池工作原理相同 |
| C、Fe为正极,石墨上发生的反应为:2H++2e-═H2↑ |
| D、若装置中的盐桥用铁丝代替,电流表指针无偏转 |
下列叙述正确的是( )
| A、生成物总能量一定低于反应物总能量 |
| B、酒精可用作燃料,说明酒精燃烧是放热反应 |
| C、硝酸铵溶于水温度降低,这个变化是吸热反应 |
| D、同温同压下,H2和Cl2在光照和点燃条件下的△H不同 |
根据所学的化学知识判断下列说法正确的是( )
| A、碘是人体必需微量元素,所以要多吃富含碘单质的食物 |
| B、福岛核电站泄露的放射性物质131I与127I所有性质完全相同 |
| C、晶体硅用于生产光导纤维 |
| D、使用清洁能源是防止酸雨发生的重要措施之一 |
常温时向某溶液中滴入石蕊试液,溶液呈蓝色,其中可能大量共存的离子是( )
| A、Fe3+、Na+、Cl-、SO42- |
| B、S2-、Na+、Cl-、ClO- |
| C、Al3+、K+、SO32-、S2- |
| D、Ag(NH3)2+、K+、Cl-、OH- |
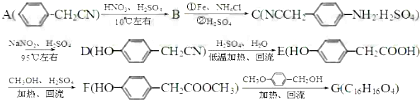
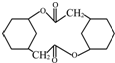 的合成路线流程图(无机试剂任选).合成路线流程图示例:CH3CH2OH
的合成路线流程图(无机试剂任选).合成路线流程图示例:CH3CH2OH