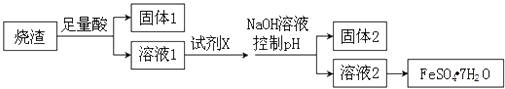
��Ŀ����
����Ŀ����֪ij���������к���NaCl���ʣ�Ϊ�ⶨ�����еĴ��������������������ͼ�е�װ�ý���ʵ�顣
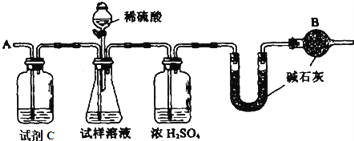
��Ҫʵ�鲽�����£�
�ٰ�ͼ��װ�����������װ�õ�������
�ڽ�a g����������ƿ�У�����������ˮ�ܽ⣬�õ�������Һ
�۳���ʢ�м�ʯ�ҵ�U�ܵ��������õ�b g
�ܴӷ�Һ©������6 mol��L-1�����ᣬֱ�����ٲ�������Ϊֹ
�ݴӵ���A����������һ�����Ŀ���
���ٴγ���ʢ�м�ʯ�ҵ�U�ܵ��������õ�c g
���ظ�����ݺ͢IJ�����ֱ��U�ܵ������������䣬Ϊd g
����պͻش����⣺
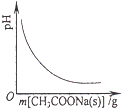
��1������������ƽ������Ʒʱ�������ƽ��ָ������ƫת��˵��___________��
��2��װ���и����B��������_______________��
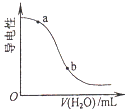
��3���������Һ©���е����ỻ��Ũ����ͬ�����ᣬ���ԵĽ��___________����ƫ�ߡ�ƫ�ͻ䣩��
��4������ݵ�Ŀ����________________����5������ߵ�Ŀ����________________��
��5���������д�������������ļ���ʽΪ____________________��
���𰸡� ��Ʒ�أ������� ��ֹ�����еĶ�����̼��ˮ������U���� ƫ�� �ѷ�Ӧ�����Ķ�����̼ȫ������U���� �жϷ�Ӧ�����Ķ�����̼�Ƿ�ȫ���ų�������U���еļ�ʯ������ ![]()
��������(1)���ڳ���ʱ�������룬������ƽ�ĸܸ�ԭ��������ƫ˵����Ʒ�أ������
�ʴ�Ϊ����Ʒ�أ������
(2)U���еļ�ʯ����Ϊ�����շ�Ӧ���ɵĶ�����̼����������Ҳ���ڶ�����̼�������B�����þ��Ƿ�ֹ�����еĶ�����̼��ˮ�ֽ���U�ܣ��Խ���������ʴ�Ϊ����ֹ�����е�CO2��ˮ������U���У�
(3)����������лӷ��ԣ�Ҳ�����Ŷ�����̼����U�ܣ�������Ϊ�Ƕ�����̼�����Զ�����̼������ƫ�������̼���Ƶ�����Ҳ��ƫ��ģ����Խ����ƫ�ʴ�Ϊ��ƫ�ߣ�
(4)���ڷ�Ӧ������ƿ�д����ж�����̼������һ�����Ŀ������ǽ������Ķ�����̼��ȫ����U�ܣ��ʴ�Ϊ���ѷ�Ӧ������CO2ȫ������U���У�
(5)ֱ��U�ܵ������������䣬˵��������̼�Ѿ���ȫ���ŵ�U���У��ʴ�Ϊ���жϷ�Ӧ������CO2�Ƿ�ȫ���ų�������U���еļ�ʯ�����գ�
(6)����Ҫ̼���Ƶ�����ΪX����
Na2CO3+H2SO4�TNa2SO4+H2O+CO2��
106 44
X d-b
�б���ʽ![]() ��
��![]() �����X=
�����X=![]() �����������д�������������ļ���ʽΪ
�����������д�������������ļ���ʽΪ![]() ��100%���ʴ�Ϊ��
��100%���ʴ�Ϊ�� ![]() ��100%��
��100%��