��Ŀ����
����Ŀ������ͼ��ʾ��װ����Ϊ�״�ȼ�ϵ��(�������ҺΪKOH��Һ)��ͨ��װ����ʵ�������϶�ͭ��
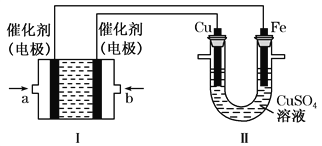
��1��b��Ӧͨ��_____(����CH3OH������O2��)��a���缫�Ϸ����ĵ缫��Ӧʽ��___________________��
��2����ƽ�����װ��������Һ��pH______(��д�����������С����������������ͬ)��װ������Cu2�������ʵ���Ũ��______________��
��3����ͭ�缫������С6.4 g�������ı���µ�O2�����Ϊ_____________________��
��4������װ��I�е������Һ����������Һ�����ڹ���������H+ ����______�缫������a������b������
���𰸡� O2 CH3OH - 6e�� + 8OH�� = CO32��+6H2O ��С ���� 1.12L b
������������������״�ȼ�ϵ�ص��ܷ�ӦΪ2CH3OH��3O2+4OH�� =2 CO32��+6H2O����ԭ���Ǽ״���Ӧͨ�븺������������������Ӧͨ�������ҡ�Ҫ��ʵ�������϶�ͭ����������������ͭ������������Iװ���������еĵ缫Ϊ�����������еĵ缫Ϊ������
��1��b��Ӧͨ��O2����a���缫�Ϸ����ĵ缫��Ӧʽ��CH3OH - 6e�� + 8OH�� = CO32��+6H2O��
��2����ƽ�����װ�â�����Һ�����������ӵ�Ũ�ȱ�С������pH��С��װ�â�������ͭ�ܽ���ͭ���ӡ�����ͭ���ӵõ��ӱ��ͭ����������Cu2�������ʵ���Ũ�Ȳ��䣻
��3����ͭ�缫������С6.4 g�����ܽ���0.1mol�����·��ͨ����0.2mol���������ݵ���ת���غ��֪��ȼ�ϵ����Ҫ����0.05mol���������ĵ�O2�ڱ���µ����Ϊ1.12L����
��4��ԭ����У�����ʵ������������������ƶ�������װ��I�е������Һ����������Һ�����ڹ���������H+ ����b�缫��

 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д� ��ĩ�����ϵ�д�
��ĩ�����ϵ�д�����Ŀ��һ���¶�ʱ��1L�ܱ������з�����Ӧ��2SO2(g)+O2(g) ![]() 2SO3(g) ��H=��196kJ/mol��������
2SO3(g) ��H=��196kJ/mol��������
��Ӧʱ��/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1��2 | |
10 | 0��4 | |
15 | 0��8 |
����˵������ȷ����
A. ��Ӧ��ǰ5min��ƽ������Ϊv (SO2)=0��08mol��L1 min1
B. �����¶Ȳ��䣬��ƽ�����������ٳ���0��2molSO2��0��1molO2ʱ��v (��)�� v (��)
C. ���������������䣬����ʼʱ�������г���2molSO3����ƽ��ʱ����78��4kJ������
D. ��ͬ�¶��£���ʼʱ�������г���1��5mol SO3����ƽ��ʱSO3��ת����Ϊ40%