题目内容
下列有关金属腐蚀与防护的说法正确的是( )
| A、在铁门上焊接铜块能防腐蚀 |
| B、镀锡铁制品的镀层破损后,镀层仍能对铁制品起保护作用 |
| C、钢柱在水下部分比在空气与水交界处更容易腐蚀 |
| D、在海轮外壳连接锌块,保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
考点:金属的电化学腐蚀与防护
专题:电化学专题
分析:A、形成原电池后,铁做负极;
B、镀层破损后,镀锡铁板的镀层不能对铁制品起保护作用;
C、空气和水是钢铁发生腐蚀的条件;
D、作原电池负极的金属加速被腐蚀,作正极的金属被保护.
B、镀层破损后,镀锡铁板的镀层不能对铁制品起保护作用;
C、空气和水是钢铁发生腐蚀的条件;
D、作原电池负极的金属加速被腐蚀,作正极的金属被保护.
解答:
解:A.铜、铁和电解质溶液构成原电池,铁作负极,加速被腐蚀,故A错误;
B、镀层破损后,镀锡铁板的镀层不能对铁制品起保护作用,加快铁板的腐蚀,故B错误;
C、空气和水是钢铁发生腐蚀的条件,其它条件相同时,氧气浓度越大,钢铁腐蚀越严重,空气和水交界处氧气浓度大于水下,所以钢柱在水下部分比在空气与水交界处更不容易腐蚀,故C错误;
作原电池负极的金属加速被腐蚀,作正极的金属被保护,锌、Fe和电解质溶液构成原电池,锌易失电子作负极、Fe作正极,所以Fe被保护,故D正确;
故选D.
B、镀层破损后,镀锡铁板的镀层不能对铁制品起保护作用,加快铁板的腐蚀,故B错误;
C、空气和水是钢铁发生腐蚀的条件,其它条件相同时,氧气浓度越大,钢铁腐蚀越严重,空气和水交界处氧气浓度大于水下,所以钢柱在水下部分比在空气与水交界处更不容易腐蚀,故C错误;
作原电池负极的金属加速被腐蚀,作正极的金属被保护,锌、Fe和电解质溶液构成原电池,锌易失电子作负极、Fe作正极,所以Fe被保护,故D正确;
故选D.
点评:本题考查金属的腐蚀与防护,明确原电池和电解池原理是解本题关键,知道金属防护的方法,难度不大.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
在标准状况下,将aLNH3完全溶于水得到VmL氨水,所得溶质的物质的量浓度为c mol/L.下列叙述中不正确的是( )
A、C=
| ||
B、已知常温下,氨水的电离常数为Ka,则pH约等于14+lg
| ||
| C、上述溶液中再加入0.5VmL同浓度稀盐酸,充分反应后c(Cl-)=c(NH4+)+c(NH3?H2O) | ||
| D、上述溶液中再加入VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
下列有关元素及其化合物知识说法正确的是( )
| A、在常温下铜与浓硝酸反应,说明硝酸只有氧化性 |
| B、铵盐加热都能分解,但不一都能生成氨气 |
| C、工业上用反应Na+KCl=NaCl+K 制取金属钾,说明钠的还原性强于钾 |
| D、溴中溶有少量的碘,可以用酒精萃取的方法提纯 |
下列实验现象和结论一致,正确的是( )
| A、氯水加入有色布条,有色布条褪色,说明溶液中有Cl2存在 |
| B、氯水溶液呈黄绿色,有刺激性气味,说明有Cl2存在 |
| C、氯水加入盐酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在 |
| D、氯水加入NaOH溶液,氯水黄绿色消失,说明有HClO存在 |
下列关于电化学知识说法正确的是( )
| A、电解AlCl3溶液,在阴极上析出金属Al |
| B、氢氧燃料电池中,氧气是正极反应物 |
| C、用惰性电极电解CuSO4溶液一段时间,溶液酸性不变 |
| D、铅蓄电池在充电时,连接电源正极的电极反应为:PbSO4+2e-═Pb+SO42- |
在考古工作中用的较多的是13C、15N的分析方法.下列关于13C、15N的叙述正确的是( )
| A、13C与15N具有相同的中子数 |
| B、C60、13C和石墨互为同素异形体 |
| C、等物质的量的13C17O、15N2两种气体具有相同的质子数和原子数 |
| D、13C、15N和C60、N70互为同位素 |
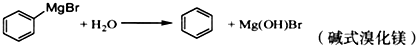
 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的合成流程如图1所示.
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的合成流程如图1所示.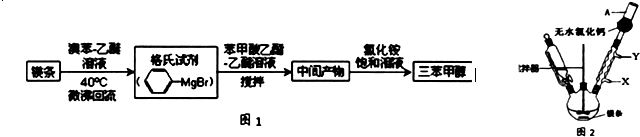
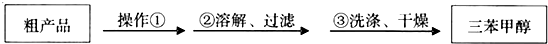
 实验室需要0.1mol/L NaOH溶液 250mL.根据这种溶液的配制情况,回答下列问题.
实验室需要0.1mol/L NaOH溶液 250mL.根据这种溶液的配制情况,回答下列问题.