题目内容
2.实验室有如下仪器①试管 ②烧杯 ③量筒 ④蒸发皿 ⑤锥形瓶 ⑥温度计⑦蒸馏烧瓶 ⑧分流漏斗
回答下列问题:
(1)可以直接加热的有①④(填序号,下同);
(2)加热时必须垫上石棉网的有②⑤⑦;
(3)使用前必须查漏的有⑧;
(4)可作反应容器的有①②⑤⑦.
分析 (1)能够直接加热的仪器有:试管、燃烧匙、蒸发皿和坩埚等;
(2)需要垫石棉网的是:烧杯、烧瓶、锥形瓶等;不能加热的仪器有:漏斗、量筒、集气瓶等;
(3)一般带活塞或者瓶塞使用过程中盛放液体的使用前需要检查是否漏水;
(4)不能用作化学反应容器即不能在该仪器内进行化学反应,根据各种仪器的使用规则,进行分析判断.
解答 解:试管、蒸发皿可直接加热;烧杯、锥形瓶、蒸馏烧瓶加热需要垫石棉网;
分液漏斗带有活塞,使用过程中为防止漏水,使用前应检查是否漏水;
量筒为精密量器,不能用于反应容器,分液漏斗为分离液体的仪器,不能用于反应容器,温度计为测量温度的仪器,不能用于反应容器,试管、烧杯、蒸发皿、锥形瓶、蒸馏烧瓶都可以做为反应容器;
所以:(1)可以直接加热的有①④;
故答案为:①④;
(2)加热时必须垫上石棉网的有②⑤⑦;
故答案为:②⑤⑦;
(3)使用前必须查漏的有⑧;
故答案为:⑧;
(4)可作反应容器的有①②⑤⑦;
故答案为:①②⑤⑦.
点评 本题难度不大,考查仪器的用途及注意事项,了解常见仪器的名称、用途、注意事项等是解答本题的关键.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
12.下列反应中氯元素全部被还原的是( )
| A. | 5Cl2+I2+6H2O=10HCl+2HIO3 | |
| B. | 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O | |
| C. | MnO2+4HCl=MnCl2+2H2O+Cl2↑ | |
| D. | 2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$ 2NaOH+Cl2↑+H2↑ |
13.关于0.5mol SO2的下列说法正确的是( )
| A. | 体积为11.2 L | B. | 摩尔质量是32g/mol | ||
| C. | 质量为64g | D. | 约含有6.02×1023个氧原子 |
10.下列气体在同温度、同压强、同质量时,体积最小的是( )
| A. | CO2 | B. | CO | C. | CH4 | D. | H2 |
7.已知充分燃烧a g乙炔(C2H2)气体时生成2mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧热的热化学方程式正确的是( )
| A. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-2b kJ/mol | |
| B. | C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-b kJ/mol | |
| C. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-4b kJ/mol | |
| D. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=b kJ/mol |
11. 如图是利用乙烯催化氧化制备乙醛同时能获得电能的一种装置,其电池总反应为2CH2=CH2+O2→2CH3CHO;下列说法错误的是( )
如图是利用乙烯催化氧化制备乙醛同时能获得电能的一种装置,其电池总反应为2CH2=CH2+O2→2CH3CHO;下列说法错误的是( )
 如图是利用乙烯催化氧化制备乙醛同时能获得电能的一种装置,其电池总反应为2CH2=CH2+O2→2CH3CHO;下列说法错误的是( )
如图是利用乙烯催化氧化制备乙醛同时能获得电能的一种装置,其电池总反应为2CH2=CH2+O2→2CH3CHO;下列说法错误的是( )| A. | 该电池可将化学能转化为电能 | |
| B. | 每有0.1 molol O2反应,则溶液中迁移0.4 mol e- | |
| C. | 负极反应式为CH2=CH2-2e-+H2O=CH3CHO+2H+ | |
| D. | 正极区溶液的pH增大 |
12.NA表示阿伏加德罗常数数值,下列有关说法正确的是( )
| A. | 18.4 mol/L的浓硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2 mol/L | |
| B. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA | |
| C. | 50 mL 14.0 mol•L-1浓硝酸与足量铜反应,转移的电子数为0.35 NA | |
| D. | 同温同压同体积下的两种气体12C18O和14N2具有的电子数相等 |
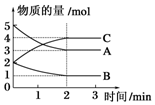 在2L固定容积的密闭容器中,在不同反应时间各物质的物质的量的变化情况如图所示.
在2L固定容积的密闭容器中,在不同反应时间各物质的物质的量的变化情况如图所示.