题目内容
16.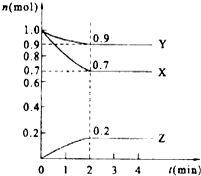 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.(1)当反应进行到第2min,该反应达到平衡.
(2)反应从开始至2分钟末,用X的浓度变化表示的平均反应速率为v(X)=0.075mol/(L*min)
(3)Y的转化率是10%
(4)由图中所给数据进行分析,该反应的化学方程为3X+Y?2Z.
分析 (1)根据曲线的变化特点判断达到平衡的时间,达平衡时各物质的量不变;
(2)根据v=$\frac{△c}{△t}$进行计算求解;
(3)Y的转化率是$\frac{Y的变化量}{Y的起始量}×100%$;
(4)根据曲线的变化趋势判断反应物和生成物,根据物质的量变化之比等于化学计量数之比书写方程式.
解答 解:(1)根据曲线的变化特点判断达到平衡的时间,达平衡时各物质的量不变,由图可知:2min时,该反应达到平衡,故答案为:2;
(2)根据v=$\frac{△c}{△t}$=$\frac{\frac{1-0.7}{2}}{2}$=0.075mol/(L*min),故答案为:0.075mol/(L*min);
(3)Y的转化率是$\frac{Y的变化量}{Y的起始量}×100%$=$\frac{1-0.9}{1}×100%$=10%,故答案为:10%;
(4)从曲线的变化趋势可以看出,从反应开始到达到平衡,X、Y的物质的量减少,应为反应物,Z的物质的量增加,应为生成物,从反应开始到第2分钟反应到达平衡状态,X、Y消耗的物质的量分别为0.3 mol、0.1 mol,Z的生成的物质的量为0.2 mol,因此三者比例为3:1:2,
物质的量变化之比等于化学计量数之比,则化学方程式为3X+Y?2Z,
故答案为:3X+Y?2Z.
点评 本题考查物质的量随时间的变化曲线,题目难度不大,本题注意化学方程式的判断方法.

练习册系列答案
相关题目
6.下列说法正确的是( )
| A. | 碱金属的单质中,锂的还原性最强 | |
| B. | 第ⅠA族元素比第ⅡA族元素的金属性强 | |
| C. | 随着核电荷数的递增,卤族元素的气态氢化物的稳定性逐渐减弱 | |
| D. | 随着核电荷数的递增,第三周期元素的氧化物对应的水化物的酸性逐渐增强. |
11.运用元素周期律分析下列推断,其中错误的是( )
| A. | 硫酸锶难溶于水 | |
| B. | 铍是一种轻金属,它的氧化物的水化物可能具有两性 | |
| C. | 硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 | |
| D. | 砹单质是一种有色固体,砹化氢很不稳定用 |
1.下列电离方程式中,正确的是( )
| A. | BaSO4?Ba2++SO42- | B. | HF═H++F- | ||
| C. | HI?H++I- | D. | NaHCO3═Na++HCO3- |
8.室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )
| A. | 溶液中导电粒子的数目增加,导电性增强 | |
| B. | 醋酸的电离程度增大,[H+]减小 | |
| C. | 电离平衡向右移动,电离常数Ka减少 | |
| D. | 稀释后溶液中由水电离出的[H+]=1×10-11 mol/L |
 Ⅰ.尿素在农业生产中起重要作用,其合成过程分两步进行:
Ⅰ.尿素在农业生产中起重要作用,其合成过程分两步进行:
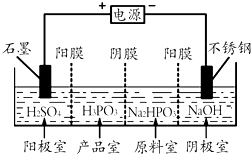 亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3?H++H2PO3-.亚磷酸与足量NaOH溶液反应,生成水和Na2HPO3.
亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3?H++H2PO3-.亚磷酸与足量NaOH溶液反应,生成水和Na2HPO3.