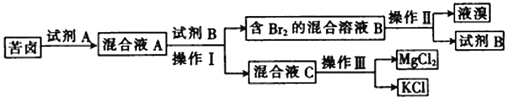
题目内容
【题目】单质铝应用极为广泛,从铝土矿中提取铝主要分以下三个阶段,根据要求回答相关问题
(1)铝土矿的提纯:铝土矿主要成分是Al2O3(含有Fe2O3、SiO2等杂质),提纯流程如下图所示:
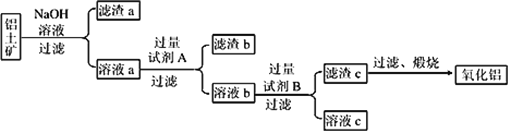
①在用NaOH溶液母液浸提过程中需研碎、湿磨,其目的是______________________________。
②向溶液a中通入过量CO2,所得不溶物煅烧后也可得Al2O3,该方法的缺点是___________________________________________________。
(2)制备无水氯化铝
其反应为:2Al2O3+6Cl2![]() 4AlCl3+O2
4AlCl3+O2
③为促进该反应的进行,实际生产中需加入焦炭,其原理是_____________________________。
(3)电解制取铝
目前可低温电解AlCl3熔盐得到金属铝纯的无水氯化铝熔点190℃,沸点180℃,其导电性如图:
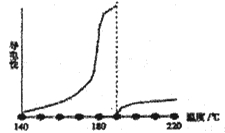
①从图中可知,AlCl3熔融液导电能力___________________________。
②但若在AlCl3中加入NaCl,使形成共融物,将AlCl3制成离子型液体,导电能力增强,熔融液中存在的阴离子是Cl-、AlCl4-、Al2Cl7-,请写AlCl3加入NaCl后形成离子型液体的两个离子方程式:AlCl3+ Cl-=AlCl4-、及平衡________________________________。
③电解时,阳极主要是AlCl4-放电,其电极反应为__________________________________。
④为保证电解进行,熔融液主要离子是AlCl4-、Al2Cl7-,则n(AlCl3)∶n(NaCl)应大于________。
【答案】 增大接触面积,加快反应速率 会使制得的Al2O3中混有SiO2杂质 焦炭与反应产生的O2产生CO2和CO,使O2浓度降低,平衡向右移动,提高转化率 导电能力差,无法电解产生铝单质 2A1Cl4-![]() Al2Cl7-+ Cl- 4 A1Cl4--2e-=2Al2Cl7-+Cl2↑ 3∶2
Al2Cl7-+ Cl- 4 A1Cl4--2e-=2Al2Cl7-+Cl2↑ 3∶2
【解析】试题分析:(1)①研碎、湿磨,能增大接触面积;②a溶液含有NaAlO2、Na2SiO3, NaAlO2、Na2SiO3与CO2反应生成氢氧化铝沉淀、硅酸沉淀;(2)③加入焦炭,与反应产生的O2产生CO2和CO;(3)①无水氯化铝熔点190℃,根据图示,大于190℃时,熔融液导电能力差;②根据电荷守恒、元素守恒书写Cl-、AlCl4-、Al2Cl7-体系中的离子方程式;③电解时,阳极是AlCl4-放电生成Al2Cl7-和氯气;④根据电解总反应![]() ,实质是电解氯化铝;
,实质是电解氯化铝;
解析:(1)①研碎、湿磨,能增大接触面积,加快反应速率;②a溶液含有NaAlO2、Na2SiO3, NaAlO2、Na2SiO3与CO2反应生成氢氧化铝沉淀、硅酸沉淀,灼烧氢氧化铝、硅酸生成Al2O3、SiO2,所以缺点是制得的Al2O3中混有SiO2杂质;(2)③加入焦炭,与反应产生的O2产生CO2和CO,使2Al2O3+6Cl2![]() 4AlCl3+O2,使O2浓度降低,平衡向右移动,提高转化率,所以实际生产中需加入焦炭;(3)①无水氯化铝熔点190℃,根据图示,大于190℃时,熔融液导电能力差,所以无法电解产生铝单质;②根据电荷守恒、元素守恒,Cl-、AlCl4-、Al2Cl7-体系中的离子方程式是2A1Cl4-
4AlCl3+O2,使O2浓度降低,平衡向右移动,提高转化率,所以实际生产中需加入焦炭;(3)①无水氯化铝熔点190℃,根据图示,大于190℃时,熔融液导电能力差,所以无法电解产生铝单质;②根据电荷守恒、元素守恒,Cl-、AlCl4-、Al2Cl7-体系中的离子方程式是2A1Cl4-![]() Al2Cl7-+ Cl-;③电解时,阳极是AlCl4-放电生成Al2Cl7-和氯气,阳极反应式是4A1Cl4--2e-=2Al2Cl7-+Cl2↑;④根据电解总反应
Al2Cl7-+ Cl-;③电解时,阳极是AlCl4-放电生成Al2Cl7-和氯气,阳极反应式是4A1Cl4--2e-=2Al2Cl7-+Cl2↑;④根据电解总反应![]() ,实质是电解氯化铝,为保证电解进行,n(AlCl3)∶n(NaCl)应大于3:2。
,实质是电解氯化铝,为保证电解进行,n(AlCl3)∶n(NaCl)应大于3:2。

 阅读快车系列答案
阅读快车系列答案【题目】氧族元素和卤族元素都能形成多种物质,我们可以利用所学物质结构的相关知识去认识和理解。
(1)H+可与H2O形成H3O+,H3O+ 立体构型为_________。H3O+中H﹣O﹣H键角比H2O中H﹣O﹣H键角大,原因为_________________________________________。
(2)COCl2的空间构型为____________;溴的价电子排布式为________________。
(3)根据已经掌握的共价键知识判断,键的极性F-H _______ O-H(“>”,“=”或“<”)
(4)溴化碘和水反应生成了一种三原子分子,该分子的结构式为____________________ ,中心原子杂化轨道类型为________________。
(5)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是________。
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(6)下列分子既不存在sp σ键,也不存在pp π键的是________。
A.HCl B.HF C.SO2 D.SCl2
(7)ClO2-立体构型为____________,写出与ClO2-互为等电子体的一种分子为______。