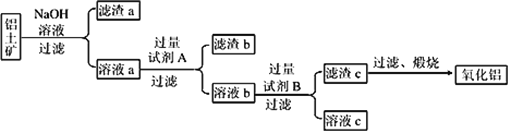
题目内容
【题目】氧族元素和卤族元素都能形成多种物质,我们可以利用所学物质结构的相关知识去认识和理解。
(1)H+可与H2O形成H3O+,H3O+ 立体构型为_________。H3O+中H﹣O﹣H键角比H2O中H﹣O﹣H键角大,原因为_________________________________________。
(2)COCl2的空间构型为____________;溴的价电子排布式为________________。
(3)根据已经掌握的共价键知识判断,键的极性F-H _______ O-H(“>”,“=”或“<”)
(4)溴化碘和水反应生成了一种三原子分子,该分子的结构式为____________________ ,中心原子杂化轨道类型为________________。
(5)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是________。
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(6)下列分子既不存在sp σ键,也不存在pp π键的是________。
A.HCl B.HF C.SO2 D.SCl2
(7)ClO2-立体构型为____________,写出与ClO2-互为等电子体的一种分子为______。
【答案】 三角锥 共用电子对多斥力大,键角大 平面三角形 4s24p5 > H-O-I sp3杂化 碘 D V形 Cl2O (或其他合理答案)
【解析】(1)根据ABm型分子的价电子对计算方法得:H3O+价电子对数=(6+1×3-1)÷2=4,其空间构型是正四面体,但参与成键的原子只有三个,所以受孤对电子的斥力影响,其结构是三角锥形; H2O中O原子有2孤对电子,H3O+中O原子只有1对孤对电子,排斥力较小,所以H3O+中H﹣O﹣H键角比H3O+中H﹣O﹣H键角大,正确答案:三角锥型 ;孤对电子对多斥力大,键角大;
(2)在COCl2结构中,成键电子对数=(4+2+0)/2=3 (碳是中心原子,提供4个价电子,卤素做配原子提供1个价电子,氧原子做配原子不提供价电子),等于3,中心原子无孤电子对,C与O原子之间形成C=O双键,碳原子是SP2杂化,其结构式是![]() ,所以它的空间构型为平面三角形所以;溴原子是35号元素,其核外电子排布式:1s22s22p63s23p63d104s24p5,所以溴的价电子排布式:4s24p5,正确答案:平面三角形;4s24p5;
,所以它的空间构型为平面三角形所以;溴原子是35号元素,其核外电子排布式:1s22s22p63s23p63d104s24p5,所以溴的价电子排布式:4s24p5,正确答案:平面三角形;4s24p5;
(3)成键原子得电子能力的差别越大,共用电子对偏移的程度越大,共价键的极性就越强,F的非金属性比O强,所以F原子得电子能够比O原子强,键的极性F-H 大于O-H,正确答案:> ;
(4)溴化碘是拟卤素,溴的非金属性比碘强,溴化碘与水反应类似与氯气与水反应,溴化碘与水反应的化学方程式为IBr+H2O=HBr+HIO,该分子的结构式:H-O-I,中心原子是O原子,H-O-I的结构可以看成是H-O-H中的一个H原子被I原子取代,所以O原子的杂化方式是:sp3杂化,正确答案:H-O-I;sp3杂化;
(5)卤族元素包含:F、Cl、Br、I元素,元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子,根据表中数据知,卤族元素中第一电离能最小的是I元素,则碘元素易失电子生成简单阳离子,正确答案:碘;
(6)HCl中存在s-pσ键, HF中存在s-pσ键, SO2中存在p-pπ键, SCl2中存在p-pσ键,所以既不存在sp σ键,也不存在pp π键的是D选项,正确答案D;
(7)根据ABm型分子的价电子对计算方法得:ClO2-价电子对数=(7+2×0+1)÷2=4,是sp3杂化,其空间构型是正四面体,但参与成键的原子只有2个,所以其空间构型是V型;等电子体是指价电子数和原子数分别都相等的物质,ClO2-中价电子数是7+6×2+1=20,所以与其互为等电子体的是分子有Cl2O、OF2,正确答案:V型 ;Cl2O4;

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案