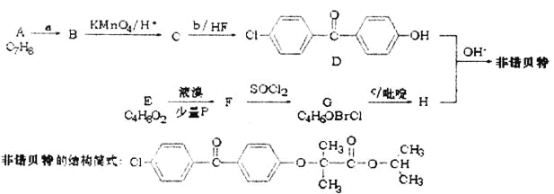
��Ŀ����
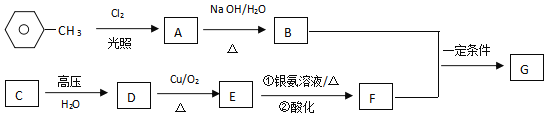
����Ŀ����ͼ��ʾΪʵ������ȡ��������������װ�á����й��ڸ�ʵ�����������ȷ����( )
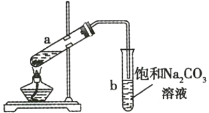
A.��a�Թ����ȼ���Ũ���ᣬȻ���ҡ���Թܱ����������Ҵ����ټ��������
B.�Թ�b�е������¶˹ܿڲ��ܽ���Һ���µ�ԭ���Ƿ�ֹʵ������з�������
C.ʵ��ʱ�����Թ�a��Ŀ��֮һ�Ǽ�ʱ����������������ʹƽ�����������������ķ����ƶ�
D.�Թ�b�б���![]() ��Һ������֮һ��������������
��Һ������֮һ��������������
���𰸡�AD
��������
A. Ũ������ܶȴ������Ҵ���������ʱ�ų��������ȣ�����ȼ�Ũ��������Һ��ɽ�������ȷ�IJ���������a�Թ��м����Ҵ��������ᣬȻ���ҡ���Թܱ���������Ũ���ᣬ��A����
B. �Թ�b�е������¶˹ܿڲ��ܽ���Һ���µ�ԭ���Ƿ�ֹʵ������з�����������B��ȷ��
C. ʵ��ʱ�����Թ�a��Ŀ��֮һ�Ǽ�ʱ����������������ʹƽ�����������������ķ����ƶ�����C��ȷ��
D. �Ʊ���������ʱ���ñ���̼������Һ�������ǣ���ȥ�Ҵ������ᣬ������������������ζ�����������������ܽ�ȡ����ڷֲ㣬��D����
��ѡAD��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��ijʵ��С����0.50 mol/L NaOH��Һ��0.50 mol/L������Һ�����к��ȵIJⶨ��
��������0.50 mol/L NaOH��Һ
��1����ʵ���д�ԼҪʹ��245 mL NaOH��Һ��������Ҫ����NaOH����________g��
��2�����ƹ�������Ҫ�õ��IJ����������ձ������������Ҫ��_________��___________��
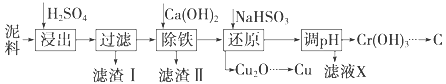
�����ⶨ�к��ȵ�ʵ��װ������ͼ��ʾ��
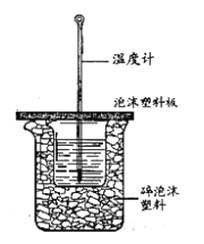
��3����С�ձ�֮����������ĭ���ϵ�������________����ʵ��װ���Ͽ���ͼ��ȱ�ٵ�һ�ֲ�������________��
��4��ʹ�ò�ȫ�������װ�ý���ʵ�飬ȡ50mL 0.25mol��L H2SO4��Һ��50mL0.55 mol��L NaOH��Һ��С�ձ��н����кͷ�Ӧ��ʵ���������±���
������д�±��еĿհף�
ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶� | �¶Ȳ�ƽ��ֵ | ||
H2SO4 | NaOH | ƽ��ֵ | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | _____�� |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
��ͨ������ɵ��к�����H��___________(��ȷ��С�����һλ)
������ʵ����ֵ�����57.3 kJ/mol��ƫ�����ƫ���ԭ�������____��������ĸ��
A��ʵ��װ�ñ��¡�����Ч����
B����ȡNaOH��Һ�����ʱ���Ӷ���
C���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
D�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶�
��5��ʵ��������60mL0��25mol��L��1H2SO4��Һ��50mL0��55mol��L��1NaOH��Һ���з�Ӧ��������ʵ����ȣ����ų�������_____________�������������������������������к���___________������������������������������50mL0.50mol��L��1�������H2SO4��Һ��������ʵ�飬��÷�Ӧǰ���¶ȵı仯ֵ��_________������ƫ��������ƫС����������Ӱ��������