题目内容
19.X、Y、Z、W、M五种元素的原子序数依次增大.已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子能形成最轻的气体单质;Y原子的最外层电子数是次外层的2倍;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;M是地壳中含量最高的金属元素.下列说法正确的是( )| A. | 五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X | |
| B. | X、Z两元素能形成原子个数比(X:Z)为3:1的化合物 | |
| C. | 化合物YW2、ZW2都是酸性氧化物 | |
| D. | 用M单质作阳极,石墨作阴极,电解NaHCO3溶液,电解一段时间后,在阴极区会出现白色沉淀 |
分析 X元素的原子能形成最轻的气体单质,该气体为氢气,则X为H元素,Y原子的最外层电子数是内层电子数的2倍,则Y为C元素;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,则Z为N元素、W为O元素;M是地壳中含量最高的金属元素,应为Al元素,结合对应单质、化合物的性质以及元素周期律知识解答该题.
解答 解:X元素的原子形成的离子就是一个质子,应为H元素,Y原子的最外层电子数是内层电子数的2倍,应为C元素;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,则Z为N元素、W为O元素;M是地壳中含量最高的金属元素,应为Al元素,
A.H原子半径最小,同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径Al>C>N>O>H,即M>Y>Z>W>X,故A错误;
B.N、H两元素能形成化合物NH3,故B正确;
C.NO2与水反应生成硝酸和NO,不是酸性氧化物,故C错误;
D.用Al单质作阳极,石墨作阴极电解NaHCO3溶液,阴极生成氢气,不会生成沉淀,故D错误;
故选B.
点评 本题考查结构位置性质关系应用,为高频考点,题目难度中等,侧重于学生的分析能力的考查,难度中等,推断元素是解题关键,注意理解根据最外层电子数关系确定元素,对学生的逻辑推理有一定的要求.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
9.下列关于元素周期表的叙述,不正确的是( )
| A. | 在金属区、非金属区交界线上,寻找具有半导体性能的材料 | |
| B. | 形成化合物种类最多的元素在第14列 | |
| C. | 第ⅡA族的右边是第ⅢB族,第ⅢA族的左边是第ⅡB族 | |
| D. | 某主族元素最高价氧化物对应的水化物的化学式为HnROm,其气态氢化物的化学式一定为H2m-nR或RH2m-n |
7.下列离子方程式书写正确的是( )
| A. | 氢氧化钠溶液中通入少量二氧化硫气体 SO2+OH-═HSO3- | |
| B. | 向硫酸铝中加入过量氨水:Al3++4NH3•H2O═AlO2-+2H2O+4NH4+ | |
| C. | NH4HCO3溶液与足量NaOH溶液共热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+2H2O+CO32- | |
| D. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+$\frac{\underline{\;\;△\;\;}}{\;}$ Fe3++3NO2↑+3H2O |
14.a、b、c、d为原子序数依次增大的短周期主族元素,a的最外层电子数为其质子数的一半,b的最外层只有1个电子,c的最高化合价与最低化合价的代数和为4.下列叙述正确的是( )
| A. | a是一种非金属元素 | |
| B. | b与氧元素组成的氧化物一定是碱性氧化物 | |
| C. | b、c、d与氢元素形成的化合物中化学键均为极性共价键 | |
| D. | c2d2中各原子的最外层均达到8电子稳定结构 |
4.氢氰酸(HCN)的下列性质中,不能证明它是弱电解质的是( )
| A. | 1mol/L 氢氰酸溶液的pH约为3 | |
| B. | 1mol/L 氢氰酸钠溶液的pH约为8.5 | |
| C. | 10 mL1mol/LHCN恰好与10 mL 1mol/L NaOH溶液完全反应 | |
| D. | 在相同条件下,HCN溶液的导电性比氢氟酸溶液的弱 |
8.在下列能源的利用过程中,不直接产生CO2的有( )
| A. | 石油 | B. | 太阳能 | C. | 氢能 | D. | 天然气 |
9.下列图中的实验方案,能达到实验目的是( )
| 实 验 方 案 | 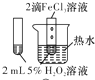 | 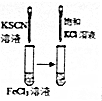 | 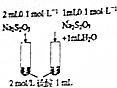 | 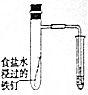 |
| 目 的 | A.验证升高温度可加快H2O2分解 | B.探究增大c(Cl-使平衡逆向移动 | C.探究浓度对化学反应速率的影响 | D.验证铁发生析氢腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
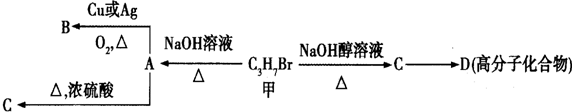
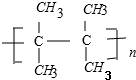 ,A中碳原子是(填“是”或者“不是”)都处在同一平面,A催化加氢后的物质用系统命名法命名名称是2,3-二甲基丁烷;在A的同系物中分子量最小的烃的电子式为CH2=CH2.
,A中碳原子是(填“是”或者“不是”)都处在同一平面,A催化加氢后的物质用系统命名法命名名称是2,3-二甲基丁烷;在A的同系物中分子量最小的烃的电子式为CH2=CH2.