题目内容
【题目】酱油是一种常用调味剂,根据国标要求酱油中NaCl的含量不应低于15g/100 mL。莫尔法是较简单的一种测量Cl-含量的方法。现采用该法测量某市售酱油是否符合NaCl含量标准要求。实验原理如下(25℃):
Ag++Cl-=AgCl↓(白色) Ksp(AgCl)=1.8×10-23
2Ag++CrO42-=Ag2CrO4↓(砖红) Ksp(Ag2CrO4)=1.2×10-22
准确移取酱油样品5.00 mL稀释至100 mL。从其中取出10.00 mL 置于锥形瓶中,再向其中加入适量的K2CrO4溶液,以0.100 0 mol/L的硝酸银标准溶液滴定,重复实验三次。
(1)样品稀释过程中,用_____移取酱油样品,应在______中定容,还需用到玻璃仪器_______________。
(2)滴定中眼睛应注视____________,出现_____________即达到滴定终点。
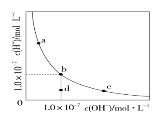
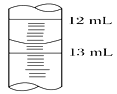
(3)滴定结束时,滴定管中液面如右图所示,则读数为________。
(4)若三次消耗硝酸银标准溶液的平均体积为12.50 mL,则稀释后的酱油中NaCl的浓度为________mol/L,该市售酱油是否符合NaCl含量标准 ________(填“符合”或“不符合”)。
(5)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),此离子沉淀完全(离子浓度≤10-5)时溶液的pH为________________已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=1.0×10-21。
【答案】酸式滴定管 100mL容量瓶 烧杯、玻璃棒、胶头滴管 锥形瓶中颜色变化 砖红色沉淀,且30s内不消失 12.70 0.1250 不符合 Cu2+ 6
【解析】
(1)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)硝酸银见光易分解,要避光;滴定操作中,眼睛应该注视着锥形瓶中溶液的颜色变化;根据滴定原理:氯离子首先与银离子反应,然后重铬酸根离子与银离子反应,据此解答;
(3)根据滴定管的结构和精确度确定溶液的体积;
(4)根据Ag++Cl-=AgCl来计算稀释后的酱油中NaCl的浓度;根据稀释时溶质的物质的量不变求出原酱油中NaCl浓度,从而计算出NaCl含量,以判断是否合格;
(5)根据25℃时Cu(OH)2、Mg(OH)2的溶度积常数判断首先产生的沉淀的物质;根据溶度积常数计算此时溶液中c(OH-),结合Kw=10-14及pH=-lgc(H+)计算此时溶液的pH。
(1)样品稀释过程中,用酸式滴定管移取酱油样品,应在100 mL容量瓶中定容,还需用到的玻璃仪器有烧杯、玻璃棒、胶头滴管;
(2)硝酸银见光易分解,要避光,所以标准硝酸银溶液用棕色滴定管盛装;在进行滴定时,眼睛应注视试剂瓶中颜色变化,当出现砖红色沉淀,且30s内不再消失,说明溶液中氯离子完全反应,即达到滴定终点;
(3)滴定结束时,滴定管中液面如图所示,则读数为12.70mL;
(4)根据反应Ag++Cl-=AgCl,n(Ag+)=c·V=0.1000mol/L×12.50mL×10-3L/mL=1.2500×10-3mol,则c(Cl-)=![]() =0.1250mol/L,即稀释后的酱油中NaCl的浓度为0.1250mol/L;准确移取酱油样品5.00mL稀释至100mL,稀释后的酱油中NaCl的浓度为0.1250mol/L,则稀释前NaCl的浓度c(NaCl)=c(Cl-)=
=0.1250mol/L,即稀释后的酱油中NaCl的浓度为0.1250mol/L;准确移取酱油样品5.00mL稀释至100mL,稀释后的酱油中NaCl的浓度为0.1250mol/L,则稀释前NaCl的浓度c(NaCl)=c(Cl-)=![]() =2.5mol/L,其中NaCl含量为
=2.5mol/L,其中NaCl含量为![]() g/mL=14.625g/100mL<15g/100 mL,所以该酱油不符合标准;
g/mL=14.625g/100mL<15g/100 mL,所以该酱油不符合标准;
(5)Mg(OH)2、Cu(OH)2构型相同,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,由于25℃时Ksp[Mg(OH)2]=1.8×10-115Ksp[Cu(OH)2]=1.0×10-21,所以形成Cu(OH)2沉淀需要的OH-离子浓度较小,因此首先是Cu2+形成Cu(OH)2沉淀;若Cu2+离子沉淀完全即c(Cu2+)≤10-5,由于Ksp[Cu(OH)2]=c(Cu2+)·c2(OH-)=1.0×10-21,所以c(OH-)=![]() mol/L=1.0×10-8 mol/L,c(H+)=
mol/L=1.0×10-8 mol/L,c(H+)= mol/L=1.0×10-6mol/L,所以溶液的pH=6。
mol/L=1.0×10-6mol/L,所以溶液的pH=6。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】[化学—选修3:物质结构与性质]
硅是重要的半导体材料,构成了现代电子工业的基础。请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为_______,该能层具有的原子轨道数为________、电子数为___________。
(2)硅主要以硅酸盐、___________等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以___________相结合,其晶胞中共有8个原子,其中在面心位置贡献__________个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为___________________________________。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
键能/(kJmol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是______。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是___________________________。
(6)在硅酸盐中,SiO4- 4四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为______,Si与O的原子数之比为_________,化学式为__________________。

【题目】氨气是重要化工原料,在国民经济中占重要地位。工业合成氨的反应为:N2(g)+3H2(g) 2NH3(g) △H<0
(1)图表示合成NH3反应在某段时间t0→t6中反应速率与反应过程![]() 曲线图,t1、t3、t4 时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是___________(填写下列序号)
曲线图,t1、t3、t4 时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是___________(填写下列序号)
A.t0→t1 B.t2→t3 C.t3→t4 D.t5→t6
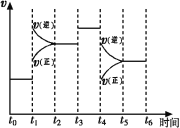
t4时改变的条件是________________。
现进行如下研究:在773K时,分别将2molN2和6molH2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(2)反应在0—10分钟内以氮气浓度变化表示的反应速率为___________,该温度下,此反应的平衡常数K=____________。
(3)该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3mo/L、3mol/L、3mo/L/span>,则此时V正_____V逆 (填“>”“<”或“=”)。
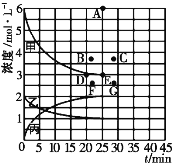
(4)由上表中的实验数据计算得到“浓度一时间”的关系可用右图中的曲线表示,表示c(N2)-t的曲线是______(填“甲”“乙”或“丙”)。在此温度下,若起始充入4molN2和12 molH2,则反应刚达到平衡时,表示c(H2)-t的曲线上相应的点为_________。
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ),
NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ),
2NO(g)+Cl2(g)![]() 2ClNO(g) K2 ΔH2<0 (Ⅱ)
2ClNO(g) K2 ΔH2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达平衡。测得10 min内v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)=_____________mol,NO的转化率α1=______________。
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2 ,其反应为:2CO+2NO![]() N2+2CO2 ΔH<0
N2+2CO2 ΔH<0
①在温度和体积保持不变的条件下,能够说明该反应达到平衡状态的标志是(________)
A.反应混合物各组分物质的量浓度相等
B.NO、CO、CO2、N2分子数之比为2:2:2:1
C.混合气体的密度保持不变
D.单位时间内消耗1molNO的同时,就有1molCO生成
②达到平衡后下列能提高NO转化率的是(________)
A.选用更有效的催化剂B.保持容器体积不变充入氦气增大压强
C.降低反应体系的温度D.缩小容器的体积
③研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
实验编号 | T(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | a | b | c | 124 |
Ⅲ | 350 | d | e | 124 |
表中:a=_______________,e=__________________