题目内容
已知反应A(g)+3B(g)?2C(g)在一定条件下达到平衡,该反应的平衡常数表达式为 .若各物质的平衡浓度分别为v(A)=2mol?L-1、v(B)=2mol?L-1、v(C)=1mol?L-1则 K= .
考点:化学平衡的计算
专题:化学平衡专题
分析:依据平衡常数概念书写,利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到.
解答:
解:反应A(g)+3B(g)?2C(g)在一定条件下达到平衡,该反应的平衡常数表达式为:
;若各物质的平衡浓度分别为v(A)=2mol?L-1、v(B)=2mol?L-1、v(C)=1mol?L-1则 K=
=
=0.0625;
故答案为:
;0.0625.
| c2(C) |
| c(A)×c3(B) |
| c2(C) |
| c(A)×c3(B) |
| 12 |
| 2×23 |
故答案为:
| c2(C) |
| c(A)×c3(B) |
点评:本题考查了化学平衡常数概念的理解应用和计算分析,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
下列说法正确的是( )
| A、相对分子质量相近的醇比烷烃沸点高是因为醇分子间存在氢键 |
| B、苯和油脂均不能使酸性高锰酸钾溶液褪色 |
| C、红外光谱分析不能区分乙醇和乙酸乙酯 |
| D、蛋白质溶液中加硫酸铵或氯化铜溶液,均会发生蛋白质的变性 |
下列各组物质仅用蒸馏水不能鉴别出的是( )
| A、苯、酒精、硝基苯 |
| B、氧化铜、二氧化锰、活性碳 |
| C、食盐、烧碱、硝酸铵 |
| D、蔗糖、硫酸铜粉末、碳酸钙粉末 |
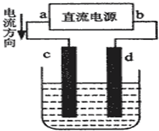 如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )
如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )| A、a为负极、b为正极 |
| B、电解过程中,c电极发生还原反应 |
| C、电解过程中,d电极质量增加 |
| D、电解过程中,氯离子浓度不变 |
 如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )| A、常压下五种元素的单质中,Z单质的熔点最高 |
| B、Z2水溶液中通入YO2后褪色,表现了YO2的漂白性 |
| C、工业上合成X的氢化物采用高温高压催化剂条件 |
| D、Y、Z的阴离子电子层结构都与R原子的相同 |
用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A、标准状况下,11.2L H2O 中所含的分子数为0.5NA |
| B、常温下,32g O3中所含的原子数为2NA |
| C、1.0 mol?L-1NaOH溶液中所含Na+离子数为NA |
| D、5.6g Fe与2.24L Cl2充分反应,转移的电子数为0.2 NA |
下列变化中,能证明硫酸是强酸的事实是( )
| A、能使石蕊试液变红 |
| B、能跟锌反应产生氢气 |
| C、能跟氯化钠反应制氯化氢 |
| D、能跟亚硫酸钠反应制二氧化硫 |
 如图表示往某Na2CO3溶液中滴入稀盐酸产生CO2的过程:
如图表示往某Na2CO3溶液中滴入稀盐酸产生CO2的过程: