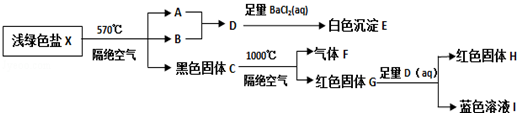
题目内容
18.写出下列物质的电离方程式:Ba(NO3)2Ba(NO3)2═Ba2++2NO3-,H2SO4H2SO4=2H++SO42-.
分析 先判断强弱电解质,强电解质在溶液中完全电离,电离方程式用等号,弱电解质在溶液中部分电离,电离方程式用可逆号,据此进行解答.
解答 解:硝酸钡电离时生成钡离子、硝酸根离子,其电离方程式为:Ba(NO3)2═Ba2++2NO3-;
硫酸在溶液中完全电离出硫酸根离子和氢离子,其电离方程式为:H2SO4=2H++SO42-,
故答案为:Ba(NO3)2═Ba2++2NO3-;H2SO4=2H++SO42-.
点评 本题考查了电离方程式的书写,题目难度不大,正确判断强弱电解质为解答关键,注意掌握电离方程式的书写原则,试题培养了学生的分析能力及规范答题能力.

练习册系列答案
相关题目
8.下列生活中的常见现象不涉及化学变化的是( )
| A. | 古铜币上出现铜绿【Cu2(OH)2CO3】 | B. | 铝制用品表面变暗 | ||
| C. | 钢铁生锈 | D. | 粗盐潮解 |
6.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2L的己烷所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数目为4NA | |
| C. | 1mol羟基所含电子数为7 NA | |
| D. | 现有乙烯、丙烯的混合气体共14g,其原子数为3 NA |
3.乙酸的下列性质中,可以证明它是弱电解质的是( )
| A. | 1mol/L乙酸溶液的pH值约为2 | |
| B. | 乙酸能与水以任何比例互溶 | |
| C. | 10mL1mol/L乙酸恰好与10mL1mol/LNaOH溶液完全反应 | |
| D. | 乙酸可以除去水垢 |
10.在密闭容器中进行反应:X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度可能是( )
| A. | c(Z)=0.4 mol/L | B. | c(X2)=0.2mol/L | ||
| C. | c(Y2)=0.4mol/L | D. | c(X2)+c(Y2)+c(Z)=0.6mol/L |
7.下列各反应中,生成物不随反应条件或反应物的用量变化而变化的是( )
| A. | Na 和O2 | B. | NaOH 和 CO2 | C. | AlCl3 和氨水 | D. | Na2CO3 和HCl |
9.用钠与水、铁与稀硫酸、铝与氢氧化钠溶液分别进行反应,若制取等物质的量的氢气,三种金属的物质的量之比是( )
| A. | 23:24:27 | B. | 1:2:3 | C. | 6:3:2 | D. | 6:2:3 |