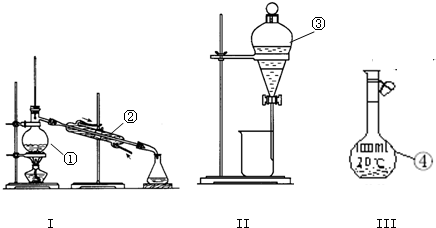
题目内容
欲用98%的浓硫酸(ρ=1.84g?cm-3)配制浓度为1.00mol?L-1的稀硫酸500mL.(1)选用的主要仪器有烧杯、
(2)现有下列配制操作,正确的顺序为
A.选用合适的量筒量取所需的浓硫酸
B.反复颠倒摇匀
C.用胶头滴管加水至刻度线
D.选择需要的仪器并洗涤干净
E.在烧杯中稀释浓硫酸
F.待溶液冷却后转入容量瓶
G.洗涤烧杯和玻璃棒,并将洗涤液一起转入容量瓶中
(3)所需浓硫酸的体积为
(4)如果实验室有10mL、50mL、100mL的量筒,应选用
分析:(1)配制500mL 1mol/L稀硫酸的步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,根据配制步骤选用仪器;
(2)根据配制500mL 1mol/L稀硫酸的步骤对各操作进行排序;
(3)根据c=
计算出浓硫酸的物质的量浓度,再根据溶液稀释过程中溶质的物质的量不变计算出需要浓硫酸的体积;
(4)根据(3)的计算结果选用量筒规格;量筒中有蒸馏水,导致浓硫酸被稀释,量取的浓硫酸的体积偏小,硫酸的物质的量偏小,溶液浓度偏低.
(2)根据配制500mL 1mol/L稀硫酸的步骤对各操作进行排序;
(3)根据c=
| 1000ρw |
| M |
(4)根据(3)的计算结果选用量筒规格;量筒中有蒸馏水,导致浓硫酸被稀释,量取的浓硫酸的体积偏小,硫酸的物质的量偏小,溶液浓度偏低.
解答:(1)根据配制步骤可知,需要使用的仪器为:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管等,还缺少的仪器为:量筒、500 mL容量瓶、玻璃棒、胶头滴管,
故答案为:量筒、500 mL容量瓶、玻璃棒、胶头滴管;
(2)配制500mL 1mol/L稀硫酸的步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,所以正确的配制顺序为:DAEFGCB,
故答案为:DAEFGCB;
(3)质量分数为98%、密度为1.84g/cm3的浓硫酸的浓度为:
mol/L=18.4mol/L,配制500mL 1mol/L的稀硫酸,需要浓硫酸的体积为:
≈0.0272L=27.2mL,
故答案为:27.2;
(4)量取27.2mL的浓硫酸,需要使用50mL的量筒;量取时发现量筒不干净,用水洗净后若直接量取,导致浓硫酸被稀释,量取的浓硫酸中硫酸的物质的量偏小,配制的溶液浓度偏低,
故答案为:50;偏低.
故答案为:量筒、500 mL容量瓶、玻璃棒、胶头滴管;
(2)配制500mL 1mol/L稀硫酸的步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,所以正确的配制顺序为:DAEFGCB,
故答案为:DAEFGCB;
(3)质量分数为98%、密度为1.84g/cm3的浓硫酸的浓度为:
| 1000×1.84×98% |
| 98 |
| 1mol/L×0.5L |
| 18.4mol/L |
故答案为:27.2;
(4)量取27.2mL的浓硫酸,需要使用50mL的量筒;量取时发现量筒不干净,用水洗净后若直接量取,导致浓硫酸被稀释,量取的浓硫酸中硫酸的物质的量偏小,配制的溶液浓度偏低,
故答案为:50;偏低.
点评:本题考查了配制一定物质的量浓度的溶液的方法,该题是中等难度的试题,试题基础性强,贴近高考;该题难易适中,注重灵活性,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力;该题的难点在于误差分析,注意明确误差分析的方法.

练习册系列答案
相关题目