题目内容
6.下列除去杂质的实验方法正确的是( )| A. | 除去溴苯中的少量Br2:加入KI溶液,充分反应后,弃去水溶液 | |
| B. | 除去苯酚中的少量甲苯:加入酸性高锰酸钾溶液,充分反应后,弃去水溶液 | |
| C. | 除去苯中少量的苯酚:加溴水,振荡,过滤除去沉淀 | |
| D. | 除去乙醇中少量的乙酸:加足量生石灰,蒸馏 |
分析 A.溴与KI反应生成的碘易溶于溴苯;
B.苯酚、甲苯均能被高锰酸钾氧化;
C.溴、三溴苯酚均易溶于苯;
D.乙酸与CaO反应后,增大与乙醇的沸点差异.
解答 解:A.溴与KI反应生成的碘易溶于溴苯,引入新杂质,不能除杂,故A错误;
B.苯酚、甲苯均能被高锰酸钾氧化,将原物质除去,不能除杂,故B错误;
C.溴、三溴苯酚均易溶于苯,不能除杂,应加NaOH、分液,故C错误;
D.乙酸与CaO反应后,增大与乙醇的沸点差异,然后蒸馏可除杂,故D正确;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意有机物的结构与性质,题目难度不大.

练习册系列答案
相关题目
16.下列有关胶体和溶液的比较中,正确的( )
| A. | 可用滤纸过滤除去溶液中的胶体粒子 | |
| B. | 溶液中溶质的粒子运动有规律,胶体粒子运动无规律 | |
| C. | 一束光线通过溶液没有特殊现象,一束光线通过胶体时出现光亮的“通路” | |
| D. | 通直流电后,溶液中溶质的粒子分别向两极运动,而胶体中分散质的粒子向某一极运动 |
17.完成下表的空白
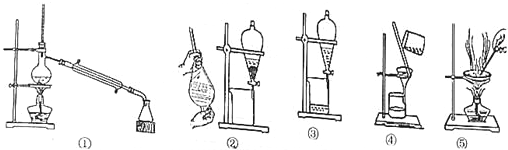

| 操作名称 | 适用对象或利用的物理性质 | 装置仪器 | 典型示例 |
| 过滤 | 除去江水中的泥沙 | ||
| 从食盐中获取NaCl晶体 | |||
| 将CCl4与水分离开 | |||
| ② | |||
| 蒸馏 | 从海水中获取淡水;工业上提纯酒精 |
14.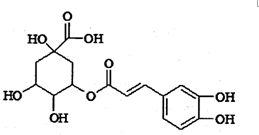 绿原酸被誉为“第七类营养素”,具有广泛的杀菌、消炎功能,其结构简式如图所示.下列有关绿原酸的说法中正确的是( )
绿原酸被誉为“第七类营养素”,具有广泛的杀菌、消炎功能,其结构简式如图所示.下列有关绿原酸的说法中正确的是( )
 绿原酸被誉为“第七类营养素”,具有广泛的杀菌、消炎功能,其结构简式如图所示.下列有关绿原酸的说法中正确的是( )
绿原酸被誉为“第七类营养素”,具有广泛的杀菌、消炎功能,其结构简式如图所示.下列有关绿原酸的说法中正确的是( )| A. | 绿原酸分子中含有3种官能团 | |
| B. | 1 mol绿原酸最多能与7molNaOH发生反应 | |
| C. | 绿原酸能发生取代反应、加成反应和消去反应 | |
| D. | 绿原酸能使酸性高锰酸钾溶液、浓溴水褪色,但反应原理不同 |
1.下列离子方程式书写正确的是( )
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+C1O- | |
| B. | 溴化钠溶液与氯气反应:2Br-+Cl2═2Cl-+Br2 | |
| C. | 氢氧化钡溶液与稀硫酸反应:H++SO42-+Ba2++OH-═H2O+BaSO42-↓ | |
| D. | 碳酸钙加入过量的盐酸中:CO32-+2H+═CO2↑+H2O |
11.化学在资源利用、环境保护等与社会可持续发展密切相关的领域发挥着积极作用.下列做法与社会可持续发展理念相违背的是( )
| A. | 回收利用金属制品,废旧电池专门回收处理 | |
| B. | 开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料 | |
| C. | 大湖名城,水资源丰富,工业废水和生活污水可任意排放 | |
| D. | 合肥一六八中学开展“校园文明活动”、“光盘行动”、减少使用瓶装水 |
18.下列化学方程式或离子方程式正确的是( )
| A. | 1一氯丙烷中加入氢氧化钠溶液并加热:CH3CH2CH2Cl+NaOH $→_{△}^{水}$CH3CH=CH2↑+NaCl+H2O | |
| B. | 苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| C. | 甲醛溶液中加入足量新制碱性Cu(OH)2悬浊液并加热HCHO+2 Cu(OH)2+OH-$\stackrel{△}{→}$ HCOO-+Cu2O↓+3H2O | |
| D. | 向小苏打溶液中加入醋酸:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- |
15.水溶液中的行为是中学化学的重要内容.
(1)25℃时,某溶液中由水电离出c(H+)=1×10-10 mol/L,该溶液pH为4或10.
(2)25℃时,测得亚硫酸氢钠溶液的pH<7,解释该溶液显酸性的原因(用离子方程式表示,并作适当解释)HSO3-+H2O?H2SO3+OH-HSO3-?H++SO32-,且电离程度大于水解程度,故溶液显酸性.
(3)电离常数是衡量弱电解质电离程度强弱的物理量.已知:
25℃时,将浓度相同的四种盐溶液:①NaCN ②NaClO ③Na2CO3 ④NaHCO3,按pH由大到小的顺序排列③>①>②>④(填序号),向84消毒液中通入少量的CO2,该反应的化学方程式为NaClO+CO2+H2O=NaHCO3+HClO.
(4)25℃时,将n mol•L-1的氨水与0.2mol•L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显中性(填“酸”、“碱”或“中”),NH3•H2O的电离常数Kb=$\frac{2×1{0}^{-8}}{n-0.2}$(用含n的代数式表示).
(1)25℃时,某溶液中由水电离出c(H+)=1×10-10 mol/L,该溶液pH为4或10.
(2)25℃时,测得亚硫酸氢钠溶液的pH<7,解释该溶液显酸性的原因(用离子方程式表示,并作适当解释)HSO3-+H2O?H2SO3+OH-HSO3-?H++SO32-,且电离程度大于水解程度,故溶液显酸性.
(3)电离常数是衡量弱电解质电离程度强弱的物理量.已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| HClO | K=3×10-8 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(4)25℃时,将n mol•L-1的氨水与0.2mol•L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显中性(填“酸”、“碱”或“中”),NH3•H2O的电离常数Kb=$\frac{2×1{0}^{-8}}{n-0.2}$(用含n的代数式表示).
19.下列说法正确的是( )
| A. | 金刚石和石墨互为同位素 | |
| B. | C2H6和C5H12互为同系物 | |
| C. | C2H4和C2H6互为同系物 | |
| D. | CH3CH2CH2CH3和CH3CH(CH3)2互为同系物 |