题目内容
【题目】由含碘废水制取碘酸钾的一种工艺如下:
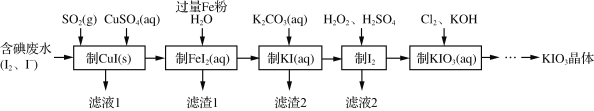
(1)H2O2的结构式为___。“制I2”过程中加入的硫酸不能过多的原因是_____。
(2)制CuI(s)步骤反应的离子方程式为_________。
(3)工艺中五种物质的制备反应中,不涉及氧化还原反应的步骤是“制___”。
(4)“制KI(aq)”时,该温度下水的离子积为Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。为避免0.9 mol·L-1 FeI2溶液中Fe2+水解生成胶状物吸附I-,起始加入K2CO3必须保持溶液的pH不大于________。
(5)“制KIO3溶液”反应的离子方程式为______。
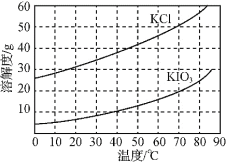
(6)KCl、KIO3的溶解度曲线如图所示。流程中由“KIO3(aq)”得到KIO3晶体的操作步骤为____。
【答案】H—O—O—H 会导致在“制KIO3(aq)”步骤中加入的KOH量过多,浪费试剂 2SO2+I2+2Cu2++4H2O=2CuI↓+2SO42-+8H+ KI(aq) 6.0 5Cl2+I2+12OH-=2IO3-+10Cl-+6H2O 蒸发浓缩,冷却结晶(过滤) (2分,“过滤”答不答都给分)
【解析】
根据流程:含碘废水中加入二氧化硫和硫酸铜发生发应:2SO2+I2+2Cu2++4H2O═2CuI↓+SO42-+8H+制备CuI(s),过滤,滤液1含硫酸,向滤渣中加入铁粉、水,发生反应:2CuI+Fe=2Cu+FeI2,制得FeI2(aq),过滤得到的滤渣1为Fe和Cu,滤液中加入碳酸钾发生反应:K2CO3+FeI2=FeCO3↓+2KI,滤渣2为FeCO3,酸性条件下,KI、过氧化氢发生氧化还原反应:2I-+2H++H2O2=H2O+I2生成碘单质,滤液2含有硫酸钾,碘单质、氯气、KOH发生反应5Cl2+I2+12OH-═2IO3-+10Cl-+6H2O,得到含有KIO3的溶液,经过蒸发浓缩,降温结晶得到KIO3晶体。
(1) H2O2的电子式为:![]() ,结构式H—O—O—H;答案为H—O—O—H;硫酸后面要加KOH,故答案为:会导致在“制KIO3(aq)”步骤中加入的KOH量过多,浪费试剂;
,结构式H—O—O—H;答案为H—O—O—H;硫酸后面要加KOH,故答案为:会导致在“制KIO3(aq)”步骤中加入的KOH量过多,浪费试剂;
(2) 通入SO2的目的是将I2还原为I,其自身被氧化为为SO42,离子反应为:2SO2+I2+2Cu2++4H2O=2CuI↓+2SO42-+8H+,故答案为:2SO2+I2+2Cu2++4H2O=2CuI↓+2SO42-+8H+;
(3) 根据分析,KI(aq)的生成无化合价升降变化,为非氧化还原反应,故答案为:KI(aq);
(4) 已知:Ksp[Fe(OH)2]=9.0×1015,现测得c( FeI2)=0.9 molL1,则由公式算的c(OH)=L=107mol/L,此温度下,Kw=1.0×1013,则c(H+)=(1×1013/107)mol/L=106mol/L,故pH=6.0,故答案为:6.0;
(5) 根据分析,“制KIO3溶液”反应的离子方程式为:5Cl2+I2+12OH-=2IO3-+10Cl-+6H2O,故答案为:5Cl2+I2+12OH-=2IO3-+10Cl-+6H2O;
(6)根据KCl、KIO3的溶解度曲线,将“KIO3(aq)”蒸发浓缩,降温结晶得到KIO3晶体,故答案为:蒸发浓缩,降温结晶。

 名校课堂系列答案
名校课堂系列答案