题目内容
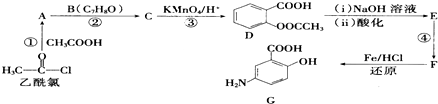
2.非布索坦(结构9)是一种用于治疗痛风的药物,它的一种合成路线如下: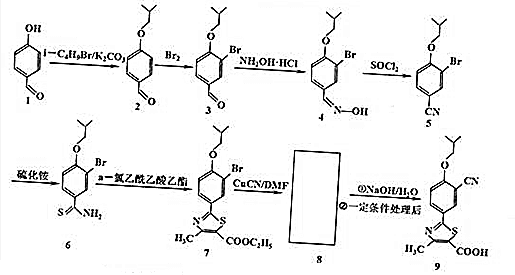
(1)有机物3中含有的官能团有醛基、醚键、溴原子(填名称),4→5的反应类型是消去反应.
(2)写出有机物6的分子式为C11H14ONBrS,8的结构简式
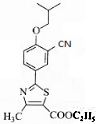 .
.(3)写出2→3的化学方程式
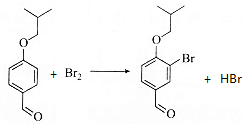 .
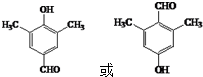
.(4)有机物2的同分异构体有很多,同时满足下列三个条件的有16种,其中核磁共振氢谱显示的峰面积比为1:2:2:6:3的结构简式为
 .
.①能发生银镜反应;
②水解产物之一遇FeCl3溶液显紫色;
③分子中除苯环外不含其它环状结构,且苯环上有四个侧链.
(5)有机物1还可以转化为有机物10,合成路线流程图如下:
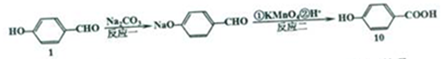
①反应一的化学方程式为
 +Na2CO3→
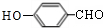
+Na2CO3→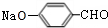 +NaHCO3,其目的是保护酚羟基,防止为氧化.
+NaHCO3,其目的是保护酚羟基,防止为氧化.②有机物10可以生成链状高聚酯,若该聚酯的相对分子质量为15000,则平均聚合度n=125.
分析 (1)由结构简式可知,有机物3含有的官能团有:醛基、醚键、溴原子;对比4、5的结构简式可知,有机物4脱去1分子水,碳氮双键转化为碳氮三键;
(2)交点、端点为碳原子,用H原子饱和碳的四价结构;对比7、9的结构简式,可知7与CuCN/DMF发生取代反应生成 ,然后在NaOH溶液中水解,酸化后可生成9;
,然后在NaOH溶液中水解,酸化后可生成9;
(3)2中醚键邻位与溴单质发生取代反应生成3,同时还生成HBr;
(4)有机物2的同分异构体同时满足下列三个条件:①能发生银镜反应,说明含有醛基,②水解产物之一遇FeCl3溶液显紫色,含有甲酸与酚形成的酯基,即取代基为-OOCH,③分子中除苯环外不含其它环状结构,且苯环上有四个侧链,另外三个取代基为:2个-CH3、1个-CH2CH3;
(5)①酚羟基的酸性比碳酸弱,反应还生成 与碳酸氢钠;反应二将醛基氧化为羧基,酸性高锰酸钾溶液也可以氧化酚羟基;
与碳酸氢钠;反应二将醛基氧化为羧基,酸性高锰酸钾溶液也可以氧化酚羟基;
②高聚酯的链节为 ,结合相对分子质量计算聚合度.
,结合相对分子质量计算聚合度.
解答 解:(1)由结构简式可知,有机物3含有的官能团有:醛基、醚键、溴原子;对比4、5的结构简式可知,有机物4脱去1分子水,碳氮双键转化为碳氮三键,属于消去反应,
故答案为:醛基、醚键、溴原子;消去反应;
(2)由结构简式可知,有机物6的分子式为C11H14ONBrS;对比7、9的结构简式,可知7与CuCN/DMF发生取代反应生成 ,然后在NaOH溶液中水解,酸化后可生成9,
,然后在NaOH溶液中水解,酸化后可生成9,
故答案为:C11H14ONBrS; ;
;
(3)2中醚键邻位与溴单质发生取代反应生成3,同时还生成HBr,反应方程式为: ,
,
故答案为: ;
;
(4)有机物2的同分异构体同时满足下列三个条件:①能发生银镜反应,说明含有醛基,②水解产物之一遇FeCl3溶液显紫色,含有甲酸与酚形成的酯基,即取代基为-OOCH,③分子中除苯环外不含其它环状结构,且苯环上有四个侧链,另外三个取代基为:2个-CH3、1个-CH2CH3,
若为 苯环上H原子被-OOCH、-CH2CH3取代,-OOCH有图
苯环上H原子被-OOCH、-CH2CH3取代,-OOCH有图 中1,2两种位置,对应的-CH2CH3分别有3种、3种位置,
中1,2两种位置,对应的-CH2CH3分别有3种、3种位置,
若为 苯环上H原子被-OOCH、-CH2CH3取代,-OOCH有图
苯环上H原子被-OOCH、-CH2CH3取代,-OOCH有图 中1,2,3三种位置,对应的-CH2CH3分别有2种、2种、3种位置,
中1,2,3三种位置,对应的-CH2CH3分别有2种、2种、3种位置,
若为 苯环上H原子被-OOCH、-CH2CH3取代,-OOCH有1种位置,而-CH2CH3有3种位置,
苯环上H原子被-OOCH、-CH2CH3取代,-OOCH有1种位置,而-CH2CH3有3种位置,
故符合条件的同分异构体共有16种,其中核磁共振氢谱显示的峰面积比为1:2:2:6:3的结构简式为 ,
,
故答案为:16; ;
;
(5)①酚羟基的酸性比碳酸弱,反应还生成 与碳酸氢钠,反应方程式为:
与碳酸氢钠,反应方程式为: +Na2CO3→
+Na2CO3→ +NaHCO3,反应二将醛基氧化为羧基,酸性高锰酸钾溶液也可以氧化酚羟基,故反应一的目的是:保护酚羟基,防止为氧化,
+NaHCO3,反应二将醛基氧化为羧基,酸性高锰酸钾溶液也可以氧化酚羟基,故反应一的目的是:保护酚羟基,防止为氧化,
故答案为: +Na2CO3→
+Na2CO3→ +NaHCO3;保护酚羟基,防止为氧化;
+NaHCO3;保护酚羟基,防止为氧化;
②高聚酯的链节为 ,该聚酯的相对分子质量为15000,则平均聚合度n=$\frac{15000}{120}$=125,
,该聚酯的相对分子质量为15000,则平均聚合度n=$\frac{15000}{120}$=125,
故答案为:125.
点评 本题考查有机物的合成、官能团结构、有机反应类型、有机物的结构与性质、限制条件同分异构体书写等,是对有机化学基础的综合考查,侧重考查学生对知识的迁移运用.

 阅读快车系列答案
阅读快车系列答案| A. | 水中加入明矾,可以起到杀菌消毒的作用 | |
| B. | 氧化铝中加入冰晶石,可以起到降低熔点的作用 | |
| C. | 药皂中加入少量苯酚,可以起到增白去污的作用 | |
| D. | 食品包装袋中放入生石灰,可以起到防止月饼等富脂食品氧化变质的作用 |
| A. | X、Y两种元素形成的化合物中原子个数比一定为2:1 | |
| B. | Z、Y两种元素形成的化合物中只能含有离子键 | |
| C. | W元素形成的单质熔点很高,是一种优良的耐火材料 | |
| D. | Z、W、Q三种元素的最高价氧化物对应的水化物能两两反应 |
| 甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇、两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
I.制备FeCO3:将0.10mol绿矾溶于水中,加入少量铁粉,边搅拌边缓慢加入1.1mol•L-1NH4HCO3溶液200mL.反应结束后过滤并洗涤沉淀.
II.制备(NH2 CH2 COO) 2Fe:实验装置如图(夹持和加热仪器已省略),利用A中反应将C中空气排净,再将上述沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,滴入柠檬酸并加热.反应结束后过滤,滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品.
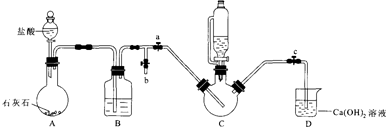
回答下列问题:
(1)实验I中:铁粉的作用是防止二价铁被氧化;生成沉淀的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(2)实验II中:
①装置B中试剂为饱和NaHCO3溶液.
②当C中空气排净后,应停止滴加盐酸,打开止水夹b,关闭止水夹a
③装置D中Ca(OH)2的作用是判断装置中控器是否排尽.
④柠檬酸可调节pH,体系pH与产率的关系如表:
| 实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
| 产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 5686. |
a.作反应终点指示剂 b.防止二价铁被氧化 c.促进FeCO3溶解 d.作催化剂
⑤乙醇的作用是降低甘氨酸亚铁在水中的溶解度,提高产率和纯度.
⑥若产品的质量为m g,则产率为$\frac{m}{20.4}$×100%.
(3)设计实验方案测定产品中二价铁含量(不必描述操作过程的细节):称取一定质量的产品溶于水中,加入适量H2SO4酸化,用KMnO4标准溶液滴定,记录消耗的体积,重复实验2-3次.
(已知产品中存在少量三价铁,且仅二价铁可以在酸性条件下被KMnO4、NaC1O或H2 O2定量快速氧化.)
| A. | 19gNHD2和19gNH2T中含有的中子数均为9NA | |
| B. | 1molCnH2n+2中含有的共用电子对数为(3n+1)NA | |
| C. | 2 mol Na2O2有的阴离子数为4NA | |
| D. | 2 mol SO2和1 molO2在一定条件下充分反应后,所得混合气体的分子数大于2NA |
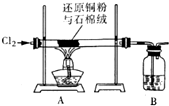 氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合成的催化剂.
氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合成的催化剂.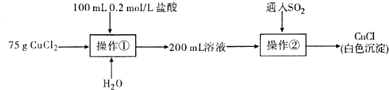
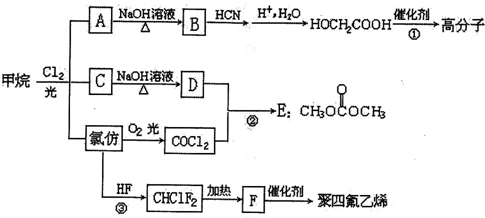

 $\stackrel{自动}{→}$
$\stackrel{自动}{→}$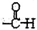
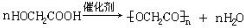 ②
②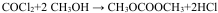
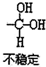
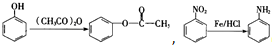 ,(具有还原性,极易被氧化)
,(具有还原性,极易被氧化) .
. .
. (写出其中一种结构简式).
(写出其中一种结构简式).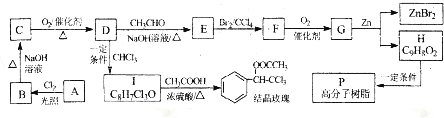
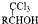
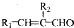 (R、R1、R2代表烃基或氢原子)
(R、R1、R2代表烃基或氢原子)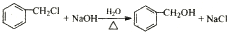 ;
;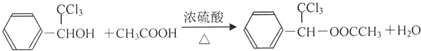 ;
;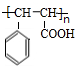 ;
;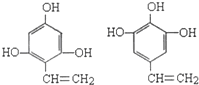 .
.