题目内容
11.下列离子方程式书写正确的是( )| A. | 用稀HNO3溶液溶解FeS固体:FeS+2H+═Fe2++H2S | |
| B. | Fe2(SO4)3的酸性溶液中通过足量硫化氢:2Fe3++H2S═2Fe2++S↓+2H+ | |
| C. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3+2HClO | |
| D. | 酸性条件下KIO3溶液与KI溶液反应生成I2:IO3-+5I-+3H2O═3I2+6OH- |
分析 A.硝酸具有强的氧化性能够氧化二价铁离子和硫离子;
B.用稀HNO3溶解FeS固体,发生氧化还原反应生成硝酸铁、S、NO和水;
C.次氯酸根离子具有强的氧化性,能够氧化二氧化硫;
D.不符合反应客观事实.
解答 解:A.用稀HNO3溶解FeS固体的离子反应为:NO3-+FeS+4H+═Fe3++S↓+NO↑+2H2O,故A错误;
B.Fe2(SO4)3的酸性溶液中通过足量硫化氢,离子方程式:2Fe3++H2S═2Fe2++S↓+2H+,故B正确;
C.少量SO2通入Ca(ClO)2溶液中的离子反应为SO2+Ca2++ClO-+H2O=CaSO4↓+2H++Cl-,故C错误;
D.酸性条件下KIO3溶液与KI溶液反应生成碘和水,离子方程式:6H++IO3-+5I-═3I2+3H2O,故D错误;
故选:B.
点评 本题考查离子反应方程式书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,题目难度不大.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
4.下列烷烃中,既能由烯烃加氢得到也能由炔烃加氢得到的是( )
| A. | 2-甲基丙烷 | B. | 2-甲基丁烷 | C. | 2,2-二甲基丙烷 | D. | 正丁烷 |
2.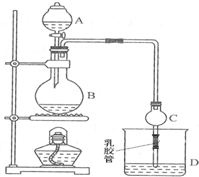 已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH.
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH.
②有关有机物的沸点如表所示:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸;B中放有乙醇、无水醋酸钠;D中放有饱和碳酸钠溶液.
试回答下列问题:
(1)浓硫酸的作用:吸水剂,催化剂,制乙酸;反应中加入过量的乙醇,目的是提高乙酸的转化率.
(2)若用同位素18O示踪法确定产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:CH3CO18OH+CH3CH2OH CH3COOCH2CH3+H218O.
CH3COOCH2CH3+H218O.
(3)仪器A的名称是分液漏斗,C的两个作用是冷却蒸汽和防止倒吸,若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-;实验完毕后,将烧杯D中溶液充分振荡、静止,现象为溶液分层,上层为无色油状液体,下层溶液颜色变浅(或褪去).
(4)从D中分离出的乙酸乙酯中还含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇(填名称);再加无水硫酸钠,然后进行蒸馏操作就可以得到较纯净的乙酸乙酯.
 已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH.
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH.②有关有机物的沸点如表所示:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
试回答下列问题:
(1)浓硫酸的作用:吸水剂,催化剂,制乙酸;反应中加入过量的乙醇,目的是提高乙酸的转化率.
(2)若用同位素18O示踪法确定产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:CH3CO18OH+CH3CH2OH
 CH3COOCH2CH3+H218O.
CH3COOCH2CH3+H218O.(3)仪器A的名称是分液漏斗,C的两个作用是冷却蒸汽和防止倒吸,若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-;实验完毕后,将烧杯D中溶液充分振荡、静止,现象为溶液分层,上层为无色油状液体,下层溶液颜色变浅(或褪去).
(4)从D中分离出的乙酸乙酯中还含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇(填名称);再加无水硫酸钠,然后进行蒸馏操作就可以得到较纯净的乙酸乙酯.
19.短周期元素A、B、C、D的原子序数依次增大,原子半径r(C)>r(D)>r(B)>r(A).B原子最外层电子数是其内层电子总数的3倍,D原子的核电荷数等于A、C原子核电荷数之和,A与C同主族.下列说法正确的是( )
| A. | 工业上常用电解熔融D的氧化物来制备D的单质 | |
| B. | 单质C、D着火,灭火时C不能用泡沫灭火器,但D可以用泡沫灭火器灭火 | |
| C. | 化合物A2B2与C2B2所含化学键类型完全相同 | |
| D. | A、B、C组成的化合物,若溶液浓度为0.01mol/L,则常温下其PH为12 |
6.下列各组离子一定能大量共存的是( )
| A. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| B. | 在强碱溶液中:K+、Na+、CO32-、AlO2- | |
| C. | PH=1的溶液中:K+、Cl-、NO3-、Fe2+ | |
| D. | 加入Al能放出H2的溶液中:HCO3-、Na+、NO3-、Cl- |
3.在同学们的日常生活中,下列过程需要加快化学反应速率的是( )
| A. | “辽宁”号航空母舰钢板腐蚀 | B. | 旺仔牛奶变质 | ||
| C. | 工业炼钢 | D. | 垃圾桶塑料老化 |

 ;
; ;
;