题目内容
(1)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是

(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒).

① 处电极入口通甲烷(填A或B),其电极反应式为
②当消耗甲烷的体积为22.4L(标准状况下)时,假设电池的能量转化率为100%,则导线中转移电子的物质的量为 ,消耗KOH的物质的量为 .

(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒).

①
②当消耗甲烷的体积为22.4L(标准状况下)时,假设电池的能量转化率为100%,则导线中转移电子的物质的量为
考点:原电池和电解池的工作原理,化学电源新型电池
专题:电化学专题
分析:(1)验证Fe3+与Cu2+氧化性强弱,在原电池中,铜作负极、其它导电的金属或非金属作正极,电解质溶液为可溶性的铁盐;
(2)①根据电子流向知,A为负极、B为正极,燃料电池中通入燃料的电极为负极、通入氧化剂的电极为正极,甲烷失电子和氢氧根离子反应生成碳酸根离子和水;
②根据甲烷和转移电子、氢氧化钾之间的关系式计算.
(2)①根据电子流向知,A为负极、B为正极,燃料电池中通入燃料的电极为负极、通入氧化剂的电极为正极,甲烷失电子和氢氧根离子反应生成碳酸根离子和水;
②根据甲烷和转移电子、氢氧化钾之间的关系式计算.
解答:
解:(1)验证Fe3+与Cu2+氧化性强弱,在原电池中,铜作负极、其它导电的金属或非金属作正极,电解质溶液为可溶性的铁盐,
①中铁作负极、Cu作正极,电池反应式为Fe+2Fe3+=3Fe2+,不能验证Fe3+与Cu2+氧化性强弱,故错误;
②中铜作负极、银作正极,电池反应式为Cu+2Fe3+=Cu2++2Fe2+,能验证Fe3+与Cu2+氧化性强弱,故正确;
③中铁发生钝化现象,Cu作负极、铁作正极,电池反应式为:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O,不能验证Fe3+与Cu2+氧化性强弱,故错误;
④中铁作负极、铜作正极,电池反应式为:Fe+Cu2+=Cu+Fe2+,不能验证Fe3+与Cu2+氧化性强弱,故错误;
故选②;
(2)①根据电子流向知,A为负极、B为正极,燃料电池中通入燃料的电极为负极、通入氧化剂的电极为正极,所以A处通入甲烷,甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH4-8e-+10OH-═CO32-+7H2O,故答案为:A;CH4-8e-+10OH-═CO32-+7H2O;
②甲烷的物质的量为1mol,导线中转移电子的物质的量=1mol×8=8mol,根据CH4-8e-+10OH-═CO32-+7H2O知,消耗KOH的物质的量为甲烷物质的量的10倍,所以消耗氢氧化钾的物质的量是10mol,
故答案为:8;10.
①中铁作负极、Cu作正极,电池反应式为Fe+2Fe3+=3Fe2+,不能验证Fe3+与Cu2+氧化性强弱,故错误;
②中铜作负极、银作正极,电池反应式为Cu+2Fe3+=Cu2++2Fe2+,能验证Fe3+与Cu2+氧化性强弱,故正确;
③中铁发生钝化现象,Cu作负极、铁作正极,电池反应式为:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O,不能验证Fe3+与Cu2+氧化性强弱,故错误;
④中铁作负极、铜作正极,电池反应式为:Fe+Cu2+=Cu+Fe2+,不能验证Fe3+与Cu2+氧化性强弱,故错误;
故选②;
(2)①根据电子流向知,A为负极、B为正极,燃料电池中通入燃料的电极为负极、通入氧化剂的电极为正极,所以A处通入甲烷,甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH4-8e-+10OH-═CO32-+7H2O,故答案为:A;CH4-8e-+10OH-═CO32-+7H2O;
②甲烷的物质的量为1mol,导线中转移电子的物质的量=1mol×8=8mol,根据CH4-8e-+10OH-═CO32-+7H2O知,消耗KOH的物质的量为甲烷物质的量的10倍,所以消耗氢氧化钾的物质的量是10mol,
故答案为:8;10.
点评:本题考查了原电池和电解池原理,根据元素化合价变化确定氧化性强弱,根据方程式中各个物理量之间的关系式进行计算,题目难度不大.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、硫酸钡难溶于水,在水溶液中不能导电,所以硫酸钡不是电解质 |
| B、强电解质在水溶液中的导电性一定比弱电解质强 |
| C、三氧化硫溶于水能导电,所以三氧化硫是电解质 |
| D、硫酸、氢氧化钡、纯碱、苛性钠都是强电解质 |
揭示下列变化的离子方程式正确的是( )
| A、明矾用于净水:Al3++3H2O═Al(OH)3↓+3H+ |
| B、钢铁吸氧腐蚀的负极反应:Fe-3e-═Fe3+ |
| C、向明矾溶液中加入少量氢氧化钡溶液:Al3++SO42-+Ba2++3OH-═BaSO4↓+Al(OH)3↓ |
D、苯酚钠饱和溶液中通入少CO2: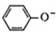 +CO2+H2O→ +CO2+H2O→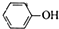 +HCO3- +HCO3- |
 如图是甲醇/过氧化氢燃料电池内部结构示意图.工作时,甲醇和过氧化氢分别进入燃料电池的燃料腔和氧化剂腔,在各自催化剂的作用下发生反应,并向外界输出电能.下列说法不正确的是( )
如图是甲醇/过氧化氢燃料电池内部结构示意图.工作时,甲醇和过氧化氢分别进入燃料电池的燃料腔和氧化剂腔,在各自催化剂的作用下发生反应,并向外界输出电能.下列说法不正确的是( )| A、该电池的正极反应式:H2O2+2H++2e-═2H2O |
| B、燃料腔中的多孔石墨电极为该燃料电池的负极,负极产生的H+通过质子交换膜流向正极 |
| C、电池工作时,1mol甲醇被氧化有6 mol电子转移 |
| D、电路中的电子经正极、负极、质子交换膜后再回到正极,形成闭合回路 |

 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.